
(7分)欲测定某生铁(主要成分是铁,还含有少量的碳)的组成,进行了如下实验:称取粉末状样品8.50克,加入某浓度的盐酸100 mL ,充分反应后,收集到标准状况下气体2.24 L ;然后,继续往样品中加入同浓度的盐酸100mL ,充分反应后又收集到标准状况下气体1.12 L 。
试求:(写出具体计算过程)
(1)所取盐酸的物质的量浓度。(2)该生铁样品中碳的质量分数(保留3位有效数字)。
(1) 2mol/L (2) 98.8﹪
解析试题分析:Fe+2HCl=FeCl2+ H2↑.由于前后两次加入的盐酸物质的量相等,放出的气体体积第二次少,说明又放出气体1.12L后生铁中的Fe已经反应完全,盐酸过量。则第一次是Fe过量,盐酸不足量。根据化学方程式可知:n(HCl)="2" n(H2)="2×(2.24L÷22.4L/mol)=0.2mol.C(HCl)=n/V=0.2mol." ÷0.1L="2mol/L." n(H2)总=3.36L÷22.4L/mol=0.15mol.。n(Fe)= n(H2)=" 0.15mol.,m(Fe)=n·M=0.15mol×56g/mol=8.40g." 所以该生铁样品中碳的质量分数为:(8.40g÷8.50g) ×100﹪=98.8﹪.
考点:考查反应物有过量时的计算及混合物中物质含量的计算的知识。


科目:高中化学 来源: 题型:填空题
如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题: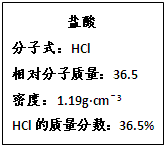
(1)该浓盐酸中HCl的物质的量浓度为___________。若用KMnO4。氧化上述HCl。其反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)1molKMnO4完全反应,反应后溶液的体积为2L,则所得产物中Cl-的物质的量浓度为____________。
(3)8molHCI完全反应,产生的Cl2在标准状况下的体积为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
写出下列物质的电子式,有结构式的请写出结构式
①氨气 、 ②氯化铵 、
③干冰 、 ④苛性钠 、
⑤冰 、 ⑥过氧化钠 、
⑦双氧水 、 ⑧HClO 、
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
二氧化硫和氮氧化物(NOx)是大气的主要污染物,治理环境污染是当前环保工作的重要研究内容之一。
完成下列计算:
(1)石灰石-石膏湿法烟气脱硫工艺技术的原理是:烟气中的二氧化硫与浆液中的碳酸钙以及空气反应生成石膏(CaSO4·2H2O)。某电厂用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,用该方法脱硫时有96%的硫转化为石膏,则理论上可得到_________吨石膏。
(2)用CH4催化还原NOx,主要产物为N2与CO2。现有1 L NOx(含NO2、NO),用CH4将其还原成N2,消耗同温同压下的CH4 0.4 L,则混合气体中NO2、NO的物质量之比为____。
(3)乙二酸(H2C2O4)的制备有如下反应:
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
C6H12O6+6HNO3→3H2C2O4+6NO↑+6H2O
上述反应产生的NOx用氧气和水吸收后生成硝酸循环利用,若尾气NOx中n(NO2)︰n(NO)=2︰1,且NOx的吸收转化率为90%。每生产9 kg乙二酸至少需要补充质量分数为63%的硝酸溶液多少千克?
(4)用碱液吸收法处理某工业尾气(含NOx:NO、NO2和N2O4)的反应为:
2NO2 + 2NaOH→ NaNO2 + NaNO3 + H2O;
NO + NO2 + 2NaOH→ 2NaNO2 + H2O。
当N2O4体积分数为0.2时,处理1mol该NOx,计算生成NaNO3和NaNO2的物质的量(x可作为已知条件使用)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(1)900 K时,用足量的H2与钠钾合金10.10 g充分反应,得到10.40g白色的氢化物混合物,则该钠钾合金的化学式为____________。
(2)将l.56 g Na2O2加入20.00g水中,充分反应后,所得溶液的质量分数为________(保留3位小数,用百分数表示保留l位小数);25℃时NaOH的溶解度为53.00 g/100g水,则将该溶液蒸发_______g水后恢复至25℃可得饱和溶液(保留2位小数)。
(3)取10.00 gNaNO3加热,得到的固体中Na的质量分数为31.51%,则氧的质量分数为_________(保留2位小数)。
(4)某碱金属R与汞的合金2.4g加入足量水中,充分反应后,收集到气体l.12 L(标准状况),则可推导出R元素是________(写元素符号)。
(5)在l.12 L密闭容器中,将KOH与O3在一定条件下反应,得到气体(只含一种元素)、固体物质A和KOH·H2O。有关实验数据如下:
| KOH | O3 | A | KOH·H2O | 气体密度 |
| 16.8 g | 0.3 mol | a g | b g | >1.429 g/L |
| 16.8 g | 0.2 mol | a g | b g | 1.429 g/L |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8:7;将m g X粉末全部溶于200 mL的浓HNO3,反应后的溶液加水稀释至2.12 L时测得其pH为0;将稀释后的溶液分为两等份,向其中一份溶液中滴加6.05 mol/L的NaOH溶液,向另一份溶液中滴加0.600 mol/L Ba(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶液的体积变化如下图所示: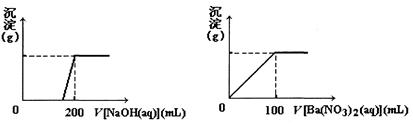
(1)请通过计算确定m的值;
(2)X的摩尔质量为368 g/mol,请确定X的化学式。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
今年暑假里学校化学实验室装修,药品被转移到了安全的场所保管,但是因为工作人员的疏忽,有几瓶氢氧化钠没有及时转移,开学后才发现,现在需要测定氢氧化钠是否有变质,变成了什么。所以某兴趣小组接下了任务,他们是这么做的:常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,反应过程中没有观察到气泡,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
| | 氢氧化钠质量(g) | 氯化钠质量(g) |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
取一定量的Fe、Cu的混合物粉末,平均分成五等份,分别向每一份中加入一定量的稀硝酸,假设反应的还原产物只有NO,若实验中生成的NO气体体积及所得剩余固体的质量记录如下(所有体积均在标准状况下测定):
| 实验序号 | 1 | 2 | 3 | 4 | 5 |
| 硝酸溶液体积 | 100 mL | 200 mL | 300 mL | 400 mL | 500 mL |
| 剩余固体的质量 | 17.2 g | 8 .0g | 0 g | 0 g | 0 g |
| 气体体积 | 2.24 L | 4.48 L | 6.72 L | 7.84 L | 7.84 L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组欲测定室温下(25 ℃、101 kPa)的气体摩尔体积,请回答以下问题。
该小组设计的简易实验装置如图所示: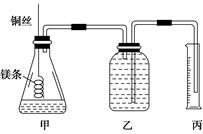
该实验的主要操作步骤如下:
①配制100 mL 1.0 mol/L的盐酸溶液;
②用________(填仪器名称并注明规格)量取10.0 mL 1.0 mol/L的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为________;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题。
(1)用文字表述实验步骤④中检查装置气密性的方法:
___________________________________________________
(2)实验步骤⑤中应选用________(填序号)的量筒。
A.100 mol B.200 mL C.500 mL
读数时除恢复到室温外,还要注意_________________________________________。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm=________,若未除去镁条表面的氧化膜,则测量结果________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com