
 ,故答案为:离子;
,故答案为:离子; ;
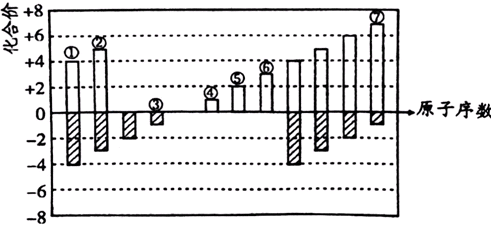
;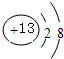 ;二氧化碳的结构式为O=C=O;根据元素周期律,电子层数越多的半径越大,电子层数相同的,原子序数越大的,半径越小,所以①-⑦中原子半径最大的是钠,所形成的单质中能形成原子晶体的是金刚石,在CCl4和NaCl中,由于CCl4是分子晶体,NaCl是离子晶体,所以熔点较高的物质是NaCl,故答案为:
;二氧化碳的结构式为O=C=O;根据元素周期律,电子层数越多的半径越大,电子层数相同的,原子序数越大的,半径越小,所以①-⑦中原子半径最大的是钠,所形成的单质中能形成原子晶体的是金刚石,在CCl4和NaCl中,由于CCl4是分子晶体,NaCl是离子晶体,所以熔点较高的物质是NaCl,故答案为: ;O=C=O;④;①;NaCl;
;O=C=O;④;①;NaCl;

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
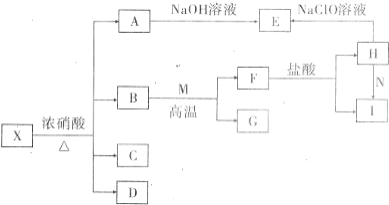 固体X是由两种常见元素组成的化合物.其中金属元素与另一元素的质量比为14:1.在一定条件下X可发生如下转化(部分产物未标出).C是无色无昧且能使澄清石灰水变浑浊的气体,D为红棕色气体,E为红褐色沉淀,M为常见金属单质.
固体X是由两种常见元素组成的化合物.其中金属元素与另一元素的质量比为14:1.在一定条件下X可发生如下转化(部分产物未标出).C是无色无昧且能使澄清石灰水变浑浊的气体,D为红棕色气体,E为红褐色沉淀,M为常见金属单质.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分散质的粒子都可以通过滤纸 |
| B、胶体是介稳定的,所以Fe(OH)3 胶体密封一段时间也会产生沉淀 |
| C、都能产生丁达尔效应 |
| D、加入盐酸先产生沉淀,然后沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molH2SO4的质量为98g/mol |
| B、摩尔是7个基本物理量之一 |
| C、6.02×1022个H2SO4分子的质量为9.8g |
| D、CO2的摩尔质量是44g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com