
【题目】一种以冷热镀管废料锌灰制ZnSO4·7H2O晶体,进而获取ZnO,并探索氢电极增压还原氧化锌电解法制锌的方法,工艺流程如图所示:
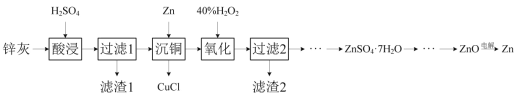
已知:①锌灰的主要成分为ZnO、ZnCl2,还含有SiO2、CuO、PbO和FeO。
②Cu++Cl-=CuCl↓
回答下列问题:
(1)滤渣1的主要成分为SiO2和___。
(2)酸浸时,硫酸浓度不能过高,原因是___。
(3)写出“沉铜”时的离子方程式___。
(4)在pH为5.6的条件下氧化后,再加入聚丙烯酰胺絮凝剂并加热搅拌,其目的是___。
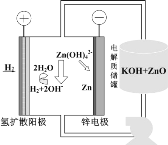
(5)氢电极增压还原氧化锌的装置如图所示,储罐内ZnO溶解后形成Zn(OH)![]() 离子,每溶解1molZnO需消耗___molKOH。电解池中的总反应离子方程式为:___。
离子,每溶解1molZnO需消耗___molKOH。电解池中的总反应离子方程式为:___。
(6)该工艺废水中含有Zn2+,排放前需处理。向废水中加入CH3COOH和CH3COONa组成的缓冲溶液调节pH,通入H2S发生反应:Zn2++H2SZnS(s)+2H+。处理后的废水中部分微粒浓度为:
微粒 | H2S | CH3COOH | CH3COO- |
浓度/mol·L-1 | 0.10 | 0.05 | 0.10 |
处理后的废水的pH=___,c(Zn2+)=___。(已知:Ksp(ZnS)=1.0×10-23,Ka1(H2S)=1.0×10-7,Ka2(H2S)=1.0×10-14,Ka(CH3COOH)=2.0×10-5)
【答案】PbSO4 产生SO2气体,污染环境或无法反应(速率慢)等 Zn+2Cu2++2Cl-=2CuCl↓+Zn2+ 促使Fe(OH)3胶体聚沉,有利于过滤分离 2 H2+Zn(OH)![]()
![]() 2H2O+Zn+2OH- 5 1×10-11mol·L-1
2H2O+Zn+2OH- 5 1×10-11mol·L-1
【解析】
锌灰(主要成分是ZnO,ZnCl2,还含有SiO2,CuO,PbO和FeO等)用硫酸酸浸,其中PbO转化成PbSO4沉淀,SiO2不溶于酸或水,则过滤得到的滤渣1主要为PbSO4、SiO2;滤液含有ZnSO4、FeSO4、CuSO4和H2SO4,向滤液中加入Zn粉,将Cu2+还原利用生成CuCl沉淀达到沉铜的目的,继续向溶液中加入双氧水将Fe2+氧化成Fe3+,再加入ZnO调节溶液pH,将Fe3+转化成氢氧化铁沉淀并过滤除去,将滤液蒸发、浓缩并冷却结晶,过滤得到ZnSO47H2O,滤液加入氢氧化钠溶液可生成氢氧化锌,加热分解生成氧化锌,最后电解生成Zn,以此解答该题。
(1)由分析可知,滤渣1的主要成分为SiO2和PbSO4;
(2)浓硫酸有强氧化性,酸浸时,如使用硫酸浓度过高,反应速率会很慢,在溶解时会氧化FeO生成Fe3+,同时生成SO2,污染环境,发生反应的化学方程式2FeO+4H2SO4(浓)=Fe2(SO4)3+SO2↑+4H2O;
(3)“沉铜”时加入Zn粉,将Cu2+还原利用生成CuCl沉淀,发生反应的离子方程式为Zn+2Cu2++2Cl-=2CuCl↓+Zn2+;
(4)在pH为5.6的条件下氧化后,生成的Fe3+水解生成氢氧化铁胶体,继续加入聚丙烯酰胺絮凝剂并加热搅拌,可促使Fe(OH)3胶体聚沉,有利于过滤分离;
(5)储罐内ZnO溶解后形成Zn(OH)![]() 离子,发生的离子反应2OH-+ZnO+H2O=Zn(OH)
离子,发生的离子反应2OH-+ZnO+H2O=Zn(OH)![]() ,则每溶解1molZnO,需消耗2molKOH;电解池阳极上的H2在碱性条件下失电子氧化生成H2O,电极反应为H2-2e-+2OH-=2H2O,阴极上Zn(OH)
,则每溶解1molZnO,需消耗2molKOH;电解池阳极上的H2在碱性条件下失电子氧化生成H2O,电极反应为H2-2e-+2OH-=2H2O,阴极上Zn(OH)![]() 离子得电子还原生成Zn,电极反应式为Zn(OH)
离子得电子还原生成Zn,电极反应式为Zn(OH)![]() +2e-=Zn+4OH-,则电解池中的总反应离子方程式为H2+Zn(OH)42-
+2e-=Zn+4OH-,则电解池中的总反应离子方程式为H2+Zn(OH)42-![]() 2H2O+Zn+2OH-;
2H2O+Zn+2OH-;
(6)已知Ka(CH3COOH)= ![]() ,则c(H+)=1×10-5mol/L,此时溶液pH=5;Ka1(H2S)×Ka2(H2S) =
,则c(H+)=1×10-5mol/L,此时溶液pH=5;Ka1(H2S)×Ka2(H2S) =![]() ×
×![]() =
=![]() =1.0×10-7×1.0×10-14,其中c(H+)=1×10-5mol/L,c(H2S)=0.10mol/L,则c(S2-)=1.0×10-12 mol/Lspan>,此时Ksp(ZnS)=1.0×10-23=c(Zn2+)×c(S2-),则c(Zn2+)=1×10-11mol·L-1。
=1.0×10-7×1.0×10-14,其中c(H+)=1×10-5mol/L,c(H2S)=0.10mol/L,则c(S2-)=1.0×10-12 mol/Lspan>,此时Ksp(ZnS)=1.0×10-23=c(Zn2+)×c(S2-),则c(Zn2+)=1×10-11mol·L-1。


科目:高中化学 来源: 题型:
【题目】为探讨浓度对化学平衡的影响,某同学对可逆反应 “2Fe3++2I-![]() 2Fe2++I2 △H<0”按下图所示步骤进行了一系列实验。
2Fe2++I2 △H<0”按下图所示步骤进行了一系列实验。

说明:0.005 mol·L-1的Fe2(SO4)3溶液颜色接近于无色。
(1)实验中要待实验Ⅰ溶液颜色不再改变时,才能进行实验Ⅱ,目的是 。
(2)实验Ⅱ中,ⅰ的现象是 ,该实验证明 。
(3)实验Ⅱ中,ⅲ的化学平衡向 移动(填“正反应方向”或“逆反应方向”);ⅲ的现象是溶液变浅,该现象 (填“能”或“不能”)说明化学平衡发生移动。如果前一空填“能”,则下一空不填;如果前一空填“不能”,则ⅲ的目的是 。
(4)实验Ⅱ中,ⅱ的现象是 ,即能证明增大生成物浓度化学平衡发生了逆向移动。
(5)除了上图中的方法外,若要使该可逆反应的化学平衡逆向移动,还可以采用的方法有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJ/mol
2H2(g)+O2(g)═2H2O(g) △H=484 kJ/mol
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:________________________________
(2)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应CO(g)+2H2(g)![]() CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
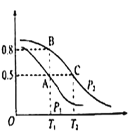
①A、B两点对应的压强大小关系是PA________PB(填“>”,“<”,“=”)
②A、B、C三点的平衡常数KA、KB、KC的大小关系是 ___________
③下列叙述能说明上述反应能达到化学平衡状态的是___(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
(3)在P1压强、T1℃时,该反应的平衡常数K=_________,再加入1.0molCO后重新到达平衡,则CO的转化率___________(填“增大”、“不变”或“减小”)
(4)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol H2:0.2mol CH3OH:0.2mol。此时v正 ________ v逆(填>、< 或 =)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL混合液中,HNO3和H2SO4的物质的量浓度分别为0.4mol/L和0.1mol/L。向该混合液中加入1.92g铜粉,加热使反应发生完全。下列说法正确的是(忽略反应前后溶液体积变化)( )
A.所得溶液中c(Cu2+)=0.225mol/L B.所得溶液中c(Cu2+)=0.03mol/L
C.所得气体在标准状况下的体积为0.448L D.反应中转移0.06mol的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.按要求填空:
(1)浓度均为0.1mol/L的①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵,四种溶液中由水电离出的H+浓度由大到小的顺序是________(填序号)。
(2)现将足量的固体AgCl分别放入下列物质中:①30mL0.02mol/LCaCl2溶液 ②20mL0.01mol/LKCl溶液 ③40mL0.03mol/LHCl溶液 ④10mL蒸馏水 ⑤50mL0.05mol/LAgNO3溶液。AgCl的溶解度由大到小的排列顺序是______(填序号)。
(3)Na2CO3溶液中离子浓度由大到小的顺序为________。
(4)CuSO4溶液中含有Fe2(SO4)3杂质,除杂试剂为________。
(5)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理________。
(6)将25℃下pH=12的Ba(OH)2溶液aL与pH=1的HCl溶液b L混合,若所得混合液为中性,则a:b=________。(溶液体积变化忽略不计)。
II.常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式________。
(2)Na2A的水溶液呈________性,原因是(用离子方程式表示):________。
(3)若溶液M由2mol/LH2A溶液与2mol/LNaOH溶液等体积混合而得,若所得溶液M的pH<7,则溶液中离子浓度由大到小顺序为________。
(4)已知Ksp(BaA)=1.8×10-10,往20mL1mol·L-1Na2A溶液中加入10mL1mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为_______mol·L-1。(忽略A2-的水解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:

(1)写出化学式:X_______,A________,B_______。
(2)实验室收集气体D和F的方法依次是_______法、________法。
(3)写出C→E的化学方程式:____________。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生兴趣小组模拟工业制取无水Na2SO3的过程如下:
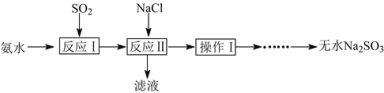
已知:①反应Ⅰ在三颈烧瓶中发生,装置如图1所示(固定及加热类仪器省略);
②H2SO3、HSO3-、SO32-在水溶液中的物质的量分数随pH的分布如图2;
③Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
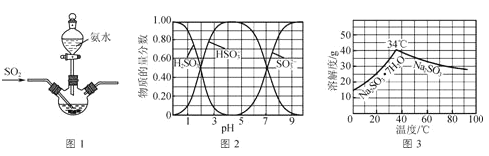
(1)为提高Na2SO3产率,反应Ⅰ应控制pH在____左右。
(2)反应Ⅱ所得滤液的主要成分是____和Na2SO3。
(3)将操作Ⅰ后所得的Na2SO3溶液加热浓缩、____(填操作),过滤出的固体用无水乙醇洗涤、在真空干燥箱中采用150℃干燥,得无水Na2SO3固体。
(4)可以用KIO3测定产品中无水Na2SO3的纯度:称取0.1260 g样品于锥形瓶中,用蒸馏水溶解,并加入淀粉做指示剂,滴加酸性KIO3溶液(amol·L-1)至Na2SO3恰好完全氧化成Na2SO4,发生反应3Na2SO3 +KIO3=3Na2SO4+KI,消耗KIO3溶液体积为bmL。通过计算确定样品中Na2SO3的质量分数____。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉和油脂为原料,制备生活中的某些物质。
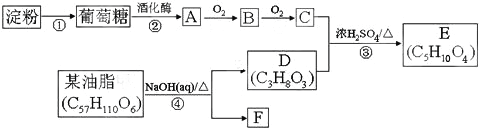
请回答:
(1)D中含有官能团的名称是____。
(2)反应④的有机反应类型是____。
(3)写出E可能的结构简式____。
(4)下列说法不正确的是____。
A.1molD最多可以和3mol金属Na反应,生成标准状况下336L氢气
B.葡萄糖、B以及淀粉这三者均能发生银镜反应
C.反应①和反应②的反应类型相同
D.A和D有相同的官能团,两者属于同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10molA和5molB放入容积为10L的密闭容器中,某温度下发生反应:3A(g)+B(g)![]() 2C(g),在最初2s内,消耗A的平均速率为0.09mol·L-1·s-1,则在2s时,
2C(g),在最初2s内,消耗A的平均速率为0.09mol·L-1·s-1,则在2s时,
(1)容器中有___________molA;
(2)此时C的物质的量浓度为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com