
【题目】某学生兴趣小组模拟工业制取无水Na2SO3的过程如下:
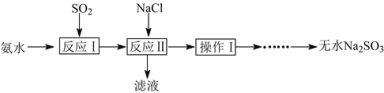
已知:①反应Ⅰ在三颈烧瓶中发生,装置如图1所示(固定及加热类仪器省略);
②H2SO3、HSO3-、SO32-在水溶液中的物质的量分数随pH的分布如图2;
③Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
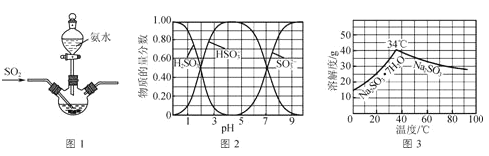
(1)为提高Na2SO3产率,反应Ⅰ应控制pH在____左右。
(2)反应Ⅱ所得滤液的主要成分是____和Na2SO3。
(3)将操作Ⅰ后所得的Na2SO3溶液加热浓缩、____(填操作),过滤出的固体用无水乙醇洗涤、在真空干燥箱中采用150℃干燥,得无水Na2SO3固体。
(4)可以用KIO3测定产品中无水Na2SO3的纯度:称取0.1260 g样品于锥形瓶中,用蒸馏水溶解,并加入淀粉做指示剂,滴加酸性KIO3溶液(amol·L-1)至Na2SO3恰好完全氧化成Na2SO4,发生反应3Na2SO3 +KIO3=3Na2SO4+KI,消耗KIO3溶液体积为bmL。通过计算确定样品中Na2SO3的质量分数____。(写出计算过程)
【答案】9.5 NH4Cl 趁热过滤 3ab×100%
【解析】
氨水中通入二氧化硫生成亚硫酸铵,亚硫酸铵溶液中加NaCl,亚硫酸氨与氯化钠反应生成氯化铵和亚硫酸钠,加热浓缩,温度控制在80℃左右,会析出Na2SO3,过滤可得Na2SO3。
(1)图2分析可知,Na2SO3的的物质的量分数在PH=9.5左右最大,为提高Na2SO3产率,反应Ⅰ应控制pH在9.5左右,故答案为:9.5;
(2)反应Ⅱ是亚硫酸氨与氯化钠反应生成氯化铵和亚硫酸钠,反应Ⅱ所得滤液的主要成分是NH4Cl、Na2SO3,故答案为:NH4Cl;
(3)Na2SO37H2O和Na2SO3的溶解度曲线可知,温度高于34°C条件下有利于亚硫酸钠析出,操作Ⅰ得到的溶液,加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤得到晶体,故答案为:趁热过滤;
(4)消耗KIO3的物质的量为a×10-3L×bmolL-1=ab×10-3mol,发生反应3Na2SO3+KIO3=3Na2SO4+KI,可得关系式:3Na2SO3~KIO3,可知n(Na2SO3)=3n(KIO3)=3ab×10-3mol,则成品中Na2SO3的质量分数=![]() ×100%=3ab×100%,故答案为:3ab×100%。
×100%=3ab×100%,故答案为:3ab×100%。


科目:高中化学 来源: 题型:
【题目】反应 2SiHCl3(g)![]() SiH2Cl2(g) + SiCl4(g)在催化剂作用下,于 323 K 和 343 K 时充分反应,SiHCl3 的转化率随时间变化的结果如图所示:
SiH2Cl2(g) + SiCl4(g)在催化剂作用下,于 323 K 和 343 K 时充分反应,SiHCl3 的转化率随时间变化的结果如图所示:
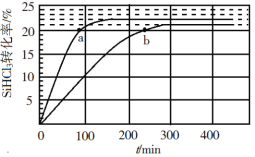
下列说法不正确的是
A.343 K 时反应物的平衡转化率为 22%
B.a、b 处反应速率大小:va>vb
C.要提高 SiHCl3 转化率,可采取的措施是降温和及时移去反应产物
D.已知反应速率![]() ,k正、k逆分别为正、逆反应速率常数,x为物质的量分数,则 343 K 时
,k正、k逆分别为正、逆反应速率常数,x为物质的量分数,则 343 K 时 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温25℃时,下列溶液里微粒间物质的量浓度的关系中正确的是( ):
A. 浓度0.1mol/L的NH4HSO3溶液:c(NH4+)+ c(H+)= c(OH-)+ c(HSO3-)+ c(SO32-)
B. 等体积等浓度Na2S和NaHS混合液:c(Na+)>c(S2-)>c(HS-)>c(OH-)>c(H+)
C. 将0.2mol/LNH3·H2O与0.1mol/LHCl等体积混合:c(Cl-)>c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+)
D. 在0.1mol/L的Na2CO3溶液中:c (OH-)=c(H+)+ c(HCO3-)+2c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以冷热镀管废料锌灰制ZnSO4·7H2O晶体,进而获取ZnO,并探索氢电极增压还原氧化锌电解法制锌的方法,工艺流程如图所示:
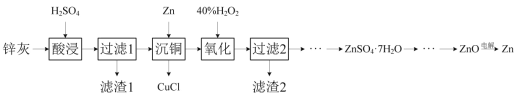
已知:①锌灰的主要成分为ZnO、ZnCl2,还含有SiO2、CuO、PbO和FeO。
②Cu++Cl-=CuCl↓
回答下列问题:
(1)滤渣1的主要成分为SiO2和___。
(2)酸浸时,硫酸浓度不能过高,原因是___。
(3)写出“沉铜”时的离子方程式___。
(4)在pH为5.6的条件下氧化后,再加入聚丙烯酰胺絮凝剂并加热搅拌,其目的是___。
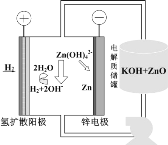
(5)氢电极增压还原氧化锌的装置如图所示,储罐内ZnO溶解后形成Zn(OH)![]() 离子,每溶解1molZnO需消耗___molKOH。电解池中的总反应离子方程式为:___。
离子,每溶解1molZnO需消耗___molKOH。电解池中的总反应离子方程式为:___。
(6)该工艺废水中含有Zn2+,排放前需处理。向废水中加入CH3COOH和CH3COONa组成的缓冲溶液调节pH,通入H2S发生反应:Zn2++H2SZnS(s)+2H+。处理后的废水中部分微粒浓度为:
微粒 | H2S | CH3COOH | CH3COO- |
浓度/mol·L-1 | 0.10 | 0.05 | 0.10 |
处理后的废水的pH=___,c(Zn2+)=___。(已知:Ksp(ZnS)=1.0×10-23,Ka1(H2S)=1.0×10-7,Ka2(H2S)=1.0×10-14,Ka(CH3COOH)=2.0×10-5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

(1)步骤③的实验操作名称是______。
(2)为检验提取碘后的水溶液中是否还含有单质碘,可选择的试剂是:_____。
(3)步骤④反应中能生成可溶性的Mn2+,写出该反应的离子方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研究发现纳米TiO2的混凝土可以适度消除汽车尾气中的氮氧化物,其原理如下。下列关于“消除”过程的叙述错误的是( )
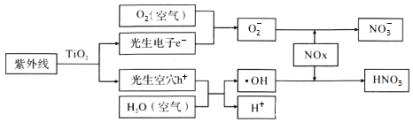
A.纳米TiO2作催化剂,NOx消除效率更高
B.NOx消除总反应为:4NOx+(5-2x)O2+2H2O![]() 4HNO3
4HNO3
C.1mol羟基(-OH)比1molO2少8NA个电子(NA为阿伏加德罗常数)
D.纳米TiO2属于胶体,能产生丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】托特罗定M合成路径如下(反应条件已略去):

已知信息:① (不稳定)
(不稳定)
②
③G遇![]() 溶液显紫色,H中含有3个六元环
溶液显紫色,H中含有3个六元环
请回答:
(1)M的分子式是__________,化合物K的结构简式是______________。
(2)下列说法正确的是__________
A.化合物B转化为C是消去反应,F转化为G是取代反应
B.化合物C转化为D的反应及F转化为G的反应都只需加入强碱后水解即可
C.![]() 化合物I与
化合物I与![]() 反应,最多消耗
反应,最多消耗![]()
D.等物质的量的A和D完全燃烧消耗的氧气量相等
(3)写出![]() 的化学方程式:__________________.
的化学方程式:__________________.
(4)M的同系物![]() 有多种同分异构体,同时符合下列条件的同分异构体的结构简式如
有多种同分异构体,同时符合下列条件的同分异构体的结构简式如 ,请再写出3种:____________________。
,请再写出3种:____________________。
①分子中含有2个独立的苯环;
②![]() 谱和
谱和![]() 谱检测显示分子中有5种化学环境不同的氢原子,有
谱检测显示分子中有5种化学环境不同的氢原子,有![]() 键,无
键,无![]() 键和
键和![]() 键。
键。
(5)设计以甲苯和乙酸酐( )为原料制备D肉桂酸(
)为原料制备D肉桂酸( )的合成路线(无机试剂任选,合成中须用到上述已知信息①②.用流程图表示):__________________________________________________________
)的合成路线(无机试剂任选,合成中须用到上述已知信息①②.用流程图表示):__________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X含有K+、Mg2+、Fe3+、Al3+、Fe2+、Cl-、CO32-、OH-、SiO32-、NO3-、SO42-中的几种,已知该溶液中各离子物质的量浓度均为0.20mol·L-1(不考虑水的电离及离子的水解)。为确定该溶液中含有的离子,现进行了如下的操作:
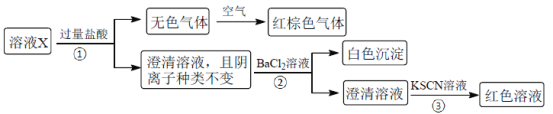
下列说法正确的是
A.无色气体可能是NO和CO2的混合物
B.由步骤③可知,原溶液肯定存在Fe3+
C.溶液X中所含离子种类共有4种
D.另取100mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为2.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
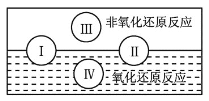
(1)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”可用如图表达。试写出有水参加的符合反应类型Ⅳ的一个化学方程式:_______,其中水为________剂。
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
____CuO+____NH4Cl ![]() ____Cu+____CuCl2+____N2↑+____H2O
____Cu+____CuCl2+____N2↑+____H2O
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是______(填元素名称),氧化剂是______(填化学式)。
③反应中若产生0.2mol的气体,则有________mol的电子转移。
(3)写出下列反应的离子方程式。
①NaHCO3溶于醋酸:____________________
②过量CO2与NaOH溶液反应:____________________
③Al(OH)3溶于NaOH溶液中:___________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com