
����Ŀ��ʵ������һ�ֹ�ҵ��������Ҫ�ɷ�ΪMgCO3��MgSO4������Fe��Al�������Ϊԭ���Ʊ�MgCO33H2O��ʵ�������ͼ1 
��1����������ȵ�Ŀ����������ʱ�õ��IJ���������
��2������H2O2����ʱ������Ӧ�����ӷ���ʽΪ ��
��3������ͼ2��ʾ��ʵ��װ�ý�����ȡ�ͷ�Һ���Գ�ȥ��Һ�е�Fe3+ �� 
��ʵ��װ��ͼ2������A������Ϊ ��
��ΪʹFe3+�����ܶ�ش�ˮ��ת�����л��࣬��ȡ�IJ�������װ����Һ������A�м���һ�������л���ȡ���������á���Һ�����ظ���Σ�
���𰸡�
��1���ӿ��������ʣ�©�� ������ �ձ�
��2��2Fe2++H2O2+2H+=2Fe3++2H2O
��3����Һ©���������
���������⣺��1�����ȣ��¶����ߣ�������Ӧ���ʣ����ӿ��������ʣ�����ʱ�õ��IJ��������У�©�� ������ �ձ������Դ��ǣ��ӿ��������ʣ�©�� ������ �ձ�����2������H2O2��Һ����������ӷ���������ԭ��Ӧ����Ӧ�����ӷ���ʽΪ��2Fe2++2H++H2O2=2Fe3++2H2O�����Դ��ǣ�2Fe2++2H++H2O2=2Fe3++2H2O����3������װ��ͼ��֪����AΪ��Һ©����������ȡ����Һ�����Դ��ǣ���Һ©��������ȡʱ��Ϊʹ���ʾ����ܱ���ȡ��Ӧ������Գ�ֽӴ������룬���Դ��ǣ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ���¶��µ��ܱ������д������·�Ӧ��2SO2��g��+O2��g��2SO3��g������֪c��SO2��=0.4mol/L��c��O2��=1mol/L�����ⶨ�÷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K=19�����жϣ�
��1����SO2��ת����Ϊ50%ʱ���÷�Ӧ�Ƿ�ﵽƽ��״̬����δ�ﵽ�����ĸ�������У�
��2����ƽ��״̬ʱ��SO2��ת����ӦΪ���٣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ����ú�ˮ�����Ʊ�ʳ�Ρ��������þ��������ʣ���������ͼ��ʾ�� 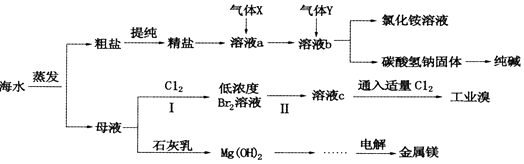
��1�����ú�ˮ���Ʊ�C12 �� Ϊ���ڴ��棬�ɽ�C12Һ����Ӧ��ȡ�Ĵ�ʩ֮һ�� ��
��2�������к��������ơ��Ȼ�þ���Ȼ��Ƶȿ��������ʣ�Ϊ��ȥ��Щ���ʶ��þ��Σ��������²��������ܽ� �ڼӹ�����BaCl2��Һ �ۼӹ�����NaOH��Һ �ܼӹ�����Na2CO3��Һ ������������ƣ���ͬ�� ������������ ��
��3������XΪ �� ��Һb�з�����Ӧ�Ļ�ѧ����ʽ�� ��
��4������I���ѻ��Br2 �� ��������ֽ�Br2��ԭΪBr�� �� ��Ŀ��Ϊ �� �������ͨ���������Br2 �� ��SO2ˮ��Һ�������գ��õ���Һc����Ӧ�����ӷ���ʽΪ �� ��ʵ�����У��ӹ�ҵ������ȡ�嵥�ʵ�ʵ����������� ��
��5����ҵ����ȡ����þ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����������ֵ���ֱ�ӷ�Ӧ���ɣ��������Ba(HCO3)2��Һ��ͬʱ������ͳ������������л������з��������������ǣ� ��
A.AlCl3
B.Na2O
C.FeCl2
D.SiO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ӣ�����Һ������������ԭ��Ӧ�����ܴ���������ǣ� ��
A.K+��NH4+��NO3-��OH-
B.Na+��Ca2+��H+��HCO3-
C.K+��H+��NO3-��I-
D.K+��NO3-��Cl-��Mg2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����FeO��Fe2O3��Fe3O4��ɵĻ����������Ԫ������Ԫ�ص�������Ϊ21��8��
��������FeO��Fe2O3��Fe3O4�����ʵ���֮�ȿ�����( )
A. 1��2��1 B. 2��1��1 C. 1��1��1 D. 2��3��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T��ʱ����2L�����ܱ���������̬����X��Y��Z�����ʵ�����ʱ��仯�IJ������������ʾ��
T/min | n��X��/mol | n��Y��/mol | n��Z��/mol |
0 | 0.80 | 1.00 | 0 |
1 | 0.70 | 0.80 | |
5 | 0.70 | ||
9 | 0.40 | ||
10 | 0.40 | 0.80 |
��1��д���÷�Ӧ�Ļ�ѧ����ʽ
��2����Ӧ���е�10min��X��ת����Ϊ �� 0��5min��Y��ƽ����Ӧ����Ϊ
��3������T��ʱ�÷�Ӧ��ƽ�ⳣ��K=
��4��T��������ܱ�������ͨ��һ������X��Y��Z����Ӧ��ijʱ�̲��X��Y��Z�����ʵ����ֱ�Ϊ1.00mol��0.50mol��1.60mol�����ʱ���淴Ӧ���ʴ�С��v��v��������ڡ��������ڡ�����С�ڡ���
��5������10min��t3��t5ʱ�̷ֱ�ı�÷�Ӧ��ijһ��Ӧ�������õ�X��Z�����ʵ�������Ӧ������ʱ��Ĺ�ϵ��ͼA��B��ʾ�� 
��10minʱ�ı�ķ�Ӧ������
��t3ʱ�̸ı�ķ�Ӧ������t5ʱ�̸ı�ķ�Ӧ������ �� ������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ��������Na2O���ʵ�Na2O2����,����ͼ��ʾ��ʵ��װ�òⶨNa2O2�����Ĵ��ȡ�(�ɹ�ѡ�õ��Լ�ֻ��CaCO3���塢6 mol��L-1���ᡢ6 mol��L-1���������ˮ)
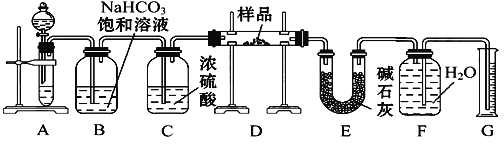
�ش���������:
��1��װ��A��Һ���Լ�ѡ��____ ��ʵ�鿪ʼǰʢװ��ҩƷ������������_____ ��B�б���NaHCO3 ��Һ�ܷ��Ϊ����Na2CO3 ��Һ ______
��2��װ��B��������________��װ��C��������________��װ��E�м�ʯ�ҵ�������___________��
��3��װ��D�з�������Ҫ��Ӧ�Ļ�ѧ����ʽ��_________ �����F���ռ����������� _____
��4����ɾȥEװ�ã��ֻ���ʲô�����______����ƫ�ߡ�ƫ�ͻ���Ӱ�죩��
��5������ʼʱ�����Ʒ������Ϊ2.0 g,��Ӧ���������������Ϊ224 mL(��״��),��Na2O2�����Ĵ���Ϊ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ɹ⻯ѧ�����ͳ�������ĵ���Ҫ���壮
��֪����CO��g��+NO2��g���TNO��g��+CO2��g����H=��akJmol��1��a��0��
��2CO��g��+2NO��g���TN2��g��+2CO2��g����H=��bkJmol��1��b��0��
���ñ�״����4.48L CO��ԭNO2��N2��CO��ȫ��Ӧ��������������ת�Ƶ��ӵ����ʵ���Ϊ �� �ų�������ΪkJ���ú���a��b�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com