
某厂平均每天产生约600 m3废氨水(NH3的浓度为153 mg·L-1,密度为1 g·cm—3。
(1)该废氨水中氨的物质的量浓度为 。
(2)对废氨水进行加热蒸发得到NH3,使废氨水中的NH3 的浓度降为17 mg·L-1。忽略蒸发前后废氨水体积变化,则上述体积的废氨水蒸发出来的NH3的物质的量为 。(以下计算结果均保留两位小数)
(3)蒸发得到的NH3可用于制备NO。4NH3+5O2 →4NO+6H2O;(不考虑NO与氧气的反应),设空气中氧气的体积分数为0.20,氮气体积分数为0.80。
①为使NH3恰好完全氧化为NO,氨—空气混合物中氨的体积分数为________。
②氨催化氧化制取NO同时会发生副反应:4NH3+3O2 →2N2+6H2O。将1L NH3混合10L空气后通入反应器,反应完成后,测得混合气体中不含NH3,而O2和N2的物质的量之比为1∶10,试求参加主反应的氨占原料氨的体积百分含量。
(4)废氨水可用于脱除烟气中的SO2。氨水吸收烟气中SO2经氧化后生成(NH4)2SO4和NH4HSO4混合物。现称取不同质量的混合物进行实验,结果如下:
| NaOH 溶液体积/mL | 40.00 | 40.00 | 40.00 |
| 样品质量/g | 7.75 | 15.50 | 23.25 |
| 氨气质量/g | 1.87 | 1.87 | 1.7 |
(1)9×10-3 mol·L-1 (2分)
(2)n(NH3)=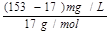 ×10-3g/mg×600m3×103L/m3="4800" mol (3分)
×10-3g/mg×600m3×103L/m3="4800" mol (3分)
(3)①0.14 (3分)
②设参加主反应NH3的为xmol,副反应的NH3为ymol
4NH3+ 5O2 →4NO+6H2O 4NH3 + 3O2 →2N2+6H2O
4 5 4 3 2
X 5x/4 y 3y/4 y/2
X+y=1 (2-5x/4-3y/4):(8+y/2)=1:10 x="0.89" (4分)
(4)7.75g混合肥料中n[(NH4)2SO4]=0.05mol,n(NH4HSO4)=0.01mol;则混合物溶解后,溶液中n(NH4+)∶n(H+)=11∶1。40.00 mL NaOH 溶液中n(NaOH)=0.13mol。n(H+)+ 11×n(H+)=0.13mol;n(H+)="0.13/12=" n(NH4HSO4),n[(NH4)2SO4]= 5×0.13/12mol
混合物质量为8.40g。(4分)(其他合理解法也给分)
解析试题分析:(1)进行单位变换:C(NH3)=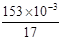 =9×10-3 mol·L-1。(2)n(NH3)=
=9×10-3 mol·L-1。(2)n(NH3)=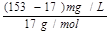 ×10-3g/mg×600m3×103L/m3="4800" mol (3分)(3)①氨和氧气的体积比为4:5,氨和空气的比值为4:25,则氨所占比例为:
×10-3g/mg×600m3×103L/m3="4800" mol (3分)(3)①氨和氧气的体积比为4:5,氨和空气的比值为4:25,则氨所占比例为: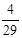 =0.14。
=0.14。
②设参加主反应NH3的为xmol,副反应的NH3为ymol
4NH3+ 5O2 →4NO+6H2O 4NH3 + 3O2 →2N2+6H2O
4 5 4 3 2
X 5x/4 y 3y/4 y/2
X+y=1 (2-5x/4-3y/4):(8+y/2)=1:10 x="0.89"
(4)7.75g混合肥料中n[(NH4)2SO4]=0.05mol,n(NH4HSO4)=0.01mol;则混合物溶解后,溶液中n(NH4+)∶n(H+)=11∶1。40.00 mL NaOH 溶液中n(NaOH)=0.13mol。n(H+)+ 11×n(H+)=0.13mol;n(H+)="0.13/12=" n(NH4HSO4),n[(NH4)2SO4]= 5×0.13/12mol,混合物质量为8.40g。
考点:本题考查化学平衡的计算,题目较为综合,且难度较大,在计算中要适当采用元素守恒。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:计算题
写出下列物质的电子式,有结构式的请写出结构式
①氨气 、 ②氯化铵 、
③干冰 、 ④苛性钠 、
⑤冰 、 ⑥过氧化钠 、
⑦双氧水 、 ⑧HClO 、
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
今年暑假里学校化学实验室装修,药品被转移到了安全的场所保管,但是因为工作人员的疏忽,有几瓶氢氧化钠没有及时转移,开学后才发现,现在需要测定氢氧化钠是否有变质,变成了什么。所以某兴趣小组接下了任务,他们是这么做的:常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,反应过程中没有观察到气泡,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
| | 氢氧化钠质量(g) | 氯化钠质量(g) |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
取一定量的Fe、Cu的混合物粉末,平均分成五等份,分别向每一份中加入一定量的稀硝酸,假设反应的还原产物只有NO,若实验中生成的NO气体体积及所得剩余固体的质量记录如下(所有体积均在标准状况下测定):
| 实验序号 | 1 | 2 | 3 | 4 | 5 |
| 硝酸溶液体积 | 100 mL | 200 mL | 300 mL | 400 mL | 500 mL |
| 剩余固体的质量 | 17.2 g | 8 .0g | 0 g | 0 g | 0 g |
| 气体体积 | 2.24 L | 4.48 L | 6.72 L | 7.84 L | 7.84 L |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
有一硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀;滤液与4.0mol·L-1NaOH溶液反应,用去35mL碱液时恰好完全中和。试求:混合液中H2SO4、HNO3的物质的量浓度各是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(1)NA为阿伏加德罗常数。25℃时,1g水中含H+离子个数约为__________NA。
(2)通过氨的催化氧化法制取硝酸,在此全过程中,理论上氨与所耗氧气的物质的量比为__________,这样所得硝酸的质量分数为_____________。
(3)往含0.2 mol NaOH和0.1 mol Ca(OH)2的混合溶液中持续稳定地通入CO2气体0.5 mol。请以CO2的量为横坐标,以溶液中离子的总量为横坐标,画出离子总量随CO2加入量变化的折线图。(不计弱电解质的电离和盐的水解)
(4)某研究性学习小组拟用铜屑与氧化铜混合物与硫酸和硝酸组成的混酸反应来制取CuSO4·5H2O晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后的溶液中不含Cu(NO3)2, 反应中固体完全溶解,两种酸均恰好完全反应。设固体混合物的总质量为480 g,其中铜屑的质量分数为0.4, 480g固体混合物与一定量混酸微热后,充分反应,冷却恰好只得到CuSO4·5H2O,试求原混酸中H2SO4的质量分数(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组欲测定室温下(25 ℃、101 kPa)的气体摩尔体积,请回答以下问题。
该小组设计的简易实验装置如图所示: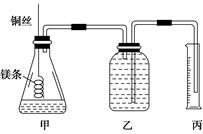
该实验的主要操作步骤如下:
①配制100 mL 1.0 mol/L的盐酸溶液;
②用________(填仪器名称并注明规格)量取10.0 mL 1.0 mol/L的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为________;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题。
(1)用文字表述实验步骤④中检查装置气密性的方法:
___________________________________________________
(2)实验步骤⑤中应选用________(填序号)的量筒。
A.100 mol B.200 mL C.500 mL
读数时除恢复到室温外,还要注意_________________________________________。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm=________,若未除去镁条表面的氧化膜,则测量结果________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列物质分类正确的是
| A.SO2、SiO2、CO均为酸性氧化物 |
| B.稀豆浆、硅酸、氯化铁溶液均为胶体 |
| C.烧碱、冰醋酸、四氯化碳均为电解质 |
| D.福尔马林、水玻璃、氨水均为混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com