
【题目】如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学方程式为2K2S2+KI3![]() K2S4 +3KI。装置(Ⅱ)为电解池的示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法不正确的是( )
K2S4 +3KI。装置(Ⅱ)为电解池的示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法不正确的是( )
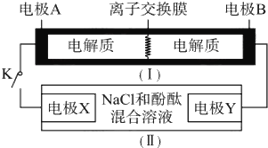
A. K+从左到右通过离子交换膜 B. 电极A上发生的反应为I3-+2e-=3I-
C. 电极Y上发生的反应为2Cl--2e-=Cl2↑ D. 当有0.1 molK+通过离子交换膜,X电极上产生1.12L气体(标准状况)
【答案】B
【解析】
当闭合开关K时,X附近溶液先变红,即X附近有氢氧根生成,所以在X极上得电子析出氢气,X极是阴极,Y极是阳极。与阴极连接的是原电池的负极,所以A极是负极,B极是正极。则
A、闭合K时,A是负极,B是正极,电子从A极流向B极,根据异性电荷相吸原理可知K+从左到右通过离子交换膜,A正确;
B、闭合K时,A是负极,负极上失电子发生氧化反应,电极反应式为2S22--2e-=S42-,B错误;
C、闭合K时,Y极是阳极,在阳极上溶液中的氯离子放电生成氯气,所以电极反应式为2Cl--2e-=Cl2↑,C正确;
D、闭合K时,当有0.1molK+通过离子交换膜,即有0.1mol电子产生,根据氢气与电子的关系式知,生成氢气的物质的量是0.05mol,体积为1.12L(标况下),D正确;
答案选B


科目:高中化学 来源: 题型:
【题目】在恒温(500K)、体积为2.0L 的密闭容器中通入1.0 mol N2和1 mol H2发生合成氨反应,20 min 后达到平衡,测得反应放出的热量为 18.4 kJ,混合气体的总物质的量为 1.6 mol。
(1)从开始反应至达到平衡时,用NH3表示该反应的化学反应速率V(NH3)=__________。
(2)该反应的热化学方程式为_____________________________________________。
(3)若拆开1 mol H—H键和1 mol N![]() N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
(4)判断该反应达到平衡状态的依据是____________(填序号)。
①单位时间内消耗1mol N2 的同时消耗了3mol H2 ;
②单位时间内断裂1mol N≡N 的同时断裂了6mol N–H;
③V正(N2)=V逆(NH3);
④NH3的物质的量分数不再随时间而变化
⑤容器内气体的压强不再随时间而变化的状态 ;
⑥容器内气体的密度不再随时间而变化的状态;
⑦c(N2):c(H2):c(NH3)=1:3:2 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以浓缩海水为原料提取溴的部分流程如右图:下列说法正确的是
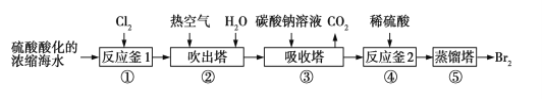
A. 海水需要浓缩,是因为海水中的Br2含量较低
B. 热空气的作用是将多余的Cl2吹出
C. 吸收塔中发生的反应是3Br2+3CO32-=5Br-+BrO3-+3CO2↑
D. 反应釜2中发生的反应是5Br-+BrO3-+3H2O=3Br2+6OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A与B反应生成C,假定反应由A、B开始,它们的初始浓度均为1.0mol·L-1。反应进行2min后A的浓度为0.8 mol·L-1,B的浓度为0.6 mol·L-1,C的浓度为0.6 mol·L-1。
⑴2min内的平均速率为V(A)=_________,V(B)=________,V(C)=________;
⑵V(A):V(B):V(C)=___________________;
⑶该反应的化学方程式为:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与人类生产、生活息息相关。回答下列问题:
(1)基态氮原子的价电子排布图是______________。
(2)B、N、O三种元素第一电离能从大到小的顺序是__________。
(3)NaNO2中氮原子的杂化方式是____________,阴离子的立体构型是__________。
(4)NF3的键角____________NH3的键角(填“<”“>”或“=”),原因是____________。
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1 mol NH4BF4含有_______mol配位键。
(6)安全气囊的设计原理为6NaN3+Fe2O3![]() 3Na2O+2Fe+9N2↑。
3Na2O+2Fe+9N2↑。
①该反应中元素的电负性由大到小的顺序是____________;
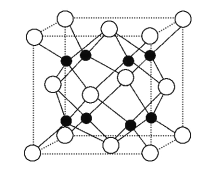
②Na2O的晶胞结构如图所示,晶胞边长为566 pm,晶胞中氧离子的配位数为____________,Na2O晶体的密度为________g·cm-3(只要求列算式,不必计算出结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都属于元素周期表中前20号元素,原子序数依次增大。元素周期表中A的电负性最大,B是同周期元素中第一电离能最小的元素,A、D同主族,B、C、D同周期,E是人体的必需元素,缺乏时易引起佝偻病,B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。根据以上信息,回答下列问题:
(1)A、D分别可形成简单气态氢化物,其中沸点较低的是____(填化学式),原因是_____。
(2)C元素原子的价电子排布图为____。
(3)B能与氧气反应生成过氧化物,写出与O22-互为等电子体的一个分子和一个离子的化学式_____、________。
(4)CO能与B和Mn形成B[Mn(CO)5],配体是____。
(5)D和铯与不同价态的铜生成两种化合物,其阴离子均为无限长链结构如图所示,a位置上的D原子的杂化轨道类型为_________。已知其中一种化合物的化学式为CsCuD3,则另一种的化学式为_________(用元素符号表示)。

(6)EA2的晶胞如图所示,若晶胞边长为x pm,则晶胞密度为____g/cm3(用NA和x表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨是利用氮气和氢气在一定条件下反应生成的。氨是重要的工业原料。请回答下列问题:
(1)氮元素在周期表中的位置是第_______周期第_______族;氮原子结构示意图为________________;
(2)写出氨分子的电子式______;指出分子中化学键是_____(填‘离子键’或‘共价键’)。
(3)写成合成氨的化学方程式:________________________;该反应是放热反应,则相同条件下“1molN2和3molH2”的能量与“2molNH3”的能量较高的是________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com