
【题目】25℃时,用NaOH调节0.1molL-1 H2C2O4溶液的pH,假设不同pH下均有![]() ,使用数字传感器测得溶液中各含碳微粒的物质的量浓度随pH的变化曲线如图。下列有关分析正确的是( )
,使用数字传感器测得溶液中各含碳微粒的物质的量浓度随pH的变化曲线如图。下列有关分析正确的是( )
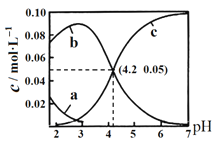
A.曲线b代表H2C2O4浓度随pH的变化
B.HC2O4- ![]() C2O42-+ H+ K = 1×10-4.2
C2O42-+ H+ K = 1×10-4.2
C.pH从4到6时主要发生反应的离子方程式为2OH- + H2C2O4 = 2H2O + C2O42-
D.当溶液pH = 7 时:![]()
【答案】B
【解析】
NaOH调节0.1molL-1 H2C2O4溶液pH时,![]() 降低、
降低、![]() 先增大后减少,
先增大后减少,![]() 一直增大,所以曲线a代表
一直增大,所以曲线a代表![]() ,曲线b代表
,曲线b代表![]() ,曲线c代表
,曲线c代表![]() 。
。
A. 根据分析可知,曲线b代表![]() 浓度随pH的变化,故A错误;
浓度随pH的变化,故A错误;
B. 根据图象可知,pH = 4.2时![]() ,则HC2O4-
,则HC2O4-![]() C2O42-+ H+的平衡常数
C2O42-+ H+的平衡常数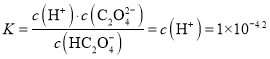 ,故B正确;
,故B正确;
C. 从图象可知pH从4到6,主要发生的反应是HC2O4-转化为C2O42-,离子方程式为:OH- + HC2O4- = H2O + C2O42-,故C错误;
D. pH = 7时![]() ,根据电荷守恒和溶液呈中性可得:
,根据电荷守恒和溶液呈中性可得:![]() ,则
,则![]() ,根据图象可知
,根据图象可知![]() ,所以溶液pH = 7时:
,所以溶液pH = 7时:![]() ,故D错误;
,故D错误;
综上所述,答案为B。


科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于区域3的是( )

A.2F2+2H2O═4HF+O2
B.AgNO3+NaCl═AgCl↓+NaNO3
C.3CO+Fe2O3 ![]() 2Fe+3CO2
2Fe+3CO2
D.MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钯(Pd)是有机合成中常用的催化剂。一种由废钯催化剂(主要成分为Pd,还有PdO、Fe有机物残留以及其他杂质)制取金属Pd的工艺流程如图:
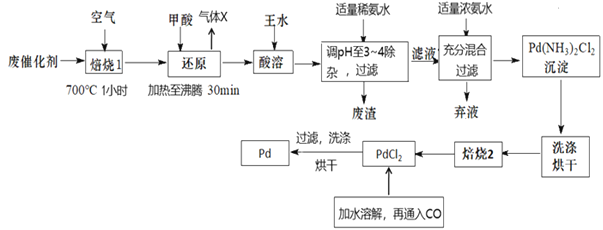
回答下列问题:
(1)废钯催化剂经烘干、粉碎后,再在700℃的高温下焙烧,不断通入足量空气的目的除了使有机物充分燃烧而除去,还可以___。
(2)查资料可知,PdO不溶于王水,加入甲酸还原PdO,其目的是___,
(3)钯在王水(浓硝酸与浓盐酸按体积比1∶3)中转化为H2PdCl4,硝酸还原为NO,该反应的化学方程式为___;酸溶时温度不能过高,原因是___。
(4)加入适量的稀氨水溶液调节pH至3~4除杂,废渣的主要成分是___。
(5)焙烧2的目的是___;
(6)有水参加情况下,可以将CO通入氯化钯(PdCl2)得到黑色金属Pd粉末,化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 水溶液中
水溶液中![]() 、
、![]() 和
和![]() 三种形态的粒子的分布分数
三种形态的粒子的分布分数![]() 随溶液pH变化的关系如图所示
随溶液pH变化的关系如图所示![]() 已知
已知![]() 。下列说法正确的是
。下列说法正确的是
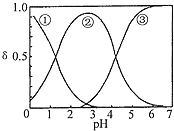
A.曲线![]() 代表的粒子是
代表的粒子是![]()
B.![]() 溶液中:
溶液中:![]()
C.![]() 时,溶液中主要含碳物质浓度大小关系为:
时,溶液中主要含碳物质浓度大小关系为:![]()
D.一定温度下,往![]() 饱和溶液中加入少量
饱和溶液中加入少量![]() 固体,
固体,![]() 将减小,
将减小,![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5.56gFeSO4·7H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,下列说法不正确的是( )
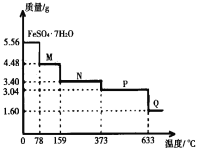
A.温度为78℃时固体物质M的化学式为FeSO4·4H2O
B.取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3
C.在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2O![]() FeSO4+H2O
FeSO4+H2O
D.温度为159℃时固体N的化学式为FeSO4·2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是一种重要的化工原料和燃料。常含有少量H2S.一种在酸性介质中进行天然气脱硫的原理示意图如图所示。下列说法正确的是
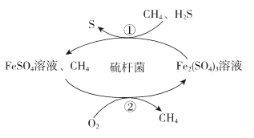
A.整个脱硫过程中Fe2(SO4)3溶液并未参与反应
B.整个脱硫过程中参加反应的n(H2S):n(O2)=2:1
C.脱硫过程需不断补充FeSO4
D.CH4是天然气脱硫过程的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,合理的是
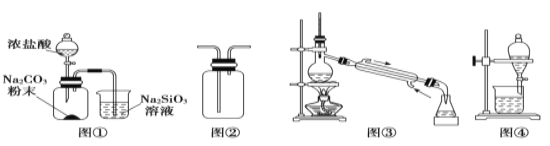
A.图①:验证C元素的非金属性强于Si
B.图②:收集CO2或NH3
C.图③:从煤干馏所得到的液体物质中分离得到粗氨水
D.图④:分离酒精与石油分馏所得到的轻质油混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2![]() O2+HbCO,37℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
O2+HbCO,37℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
A.CO与HbO2反应的平衡常数K=![]()
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用.其工作流程如下:
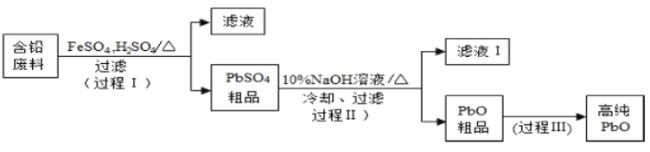
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是_______________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++PbO2+4H++![]() ═2Fe3++PbSO4+2H2O
═2Fe3++PbSO4+2H2O
ii:…
①写出ii的离子方程式:_______________。
②下列实验方案可证实上述催化过程,将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红;
b._______________。
(3)过程Ⅱ的目的是脱硫.滤液Ⅰ经处理后可在过程Ⅱ中重复使用,其目的是_______________(选填序号)。
A.减小Pb的损失,提高产品的产率
B.重复利用NaOH,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com