
【题目】用下列装置完成相关实验,合理的是
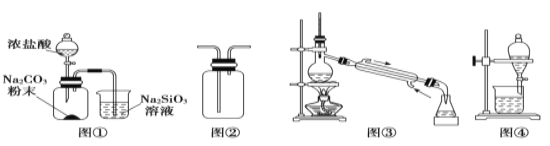
A.图①:验证C元素的非金属性强于Si
B.图②:收集CO2或NH3
C.图③:从煤干馏所得到的液体物质中分离得到粗氨水
D.图④:分离酒精与石油分馏所得到的轻质油混合物
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图所示,将纯Fe棒和石墨棒插入1 L饱和NaCl溶液中。下列说法正确的是( )

A.M连接电源负极,N连接电源正极,如果把烧杯中的溶液换成1LCuSO4溶液,反应一段时间后,烧杯中产生蓝色沉淀
B.M连接电源正极,N连接电源负极,将C电极换成Cu电极,电解质溶液换成硫酸铜溶液,则可实现在铁上镀铜
C.M连接电源正极,N连接电源负极,当两极产生气体总量为22.4mL(标准状况)时,则生成0.001molNaOH
D.去掉电源,将M、N用导线直接相连,在溶液中滴入酚酞试液,C电极周围溶液变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如图所示,下列叙述错误的是
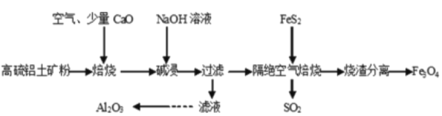
A.加入CaO可以减少SO2的排放同时生成建筑材料CaSO4
B.为了确保得到氧化铝通常向滤液中通入CO2要过量
C.残渣分离可以选择用磁铁将烧渣中的Fe3O4分离出来
D.向滤液中通入过量CO2、过滤、洗涤可制得Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用NaOH调节0.1molL-1 H2C2O4溶液的pH,假设不同pH下均有![]() ,使用数字传感器测得溶液中各含碳微粒的物质的量浓度随pH的变化曲线如图。下列有关分析正确的是( )
,使用数字传感器测得溶液中各含碳微粒的物质的量浓度随pH的变化曲线如图。下列有关分析正确的是( )
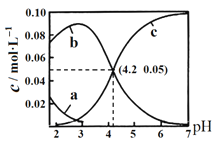
A.曲线b代表H2C2O4浓度随pH的变化
B.HC2O4- ![]() C2O42-+ H+ K = 1×10-4.2
C2O42-+ H+ K = 1×10-4.2
C.pH从4到6时主要发生反应的离子方程式为2OH- + H2C2O4 = 2H2O + C2O42-
D.当溶液pH = 7 时:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将HA和HB两种一元酸的溶液分别加水稀释,稀释时溶液pH的变化如图所示。以下叙述中不正确的是
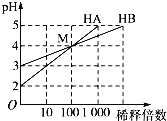
A.HB是一种弱酸
B.稀释前,![]()
C.在NaB和HB的混合溶液中一定存在:![]()
D.在M点的两种溶液中:![]() ,且
,且![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向碳酸溶液中滴加NaOH溶液,测得碳酸中含碳微粒的物质的量分数随pH变化如下图所示,下列说法不正确的是
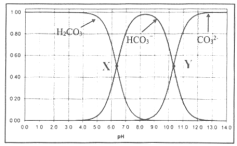
A.人体血液的![]() ,其中含碳微粒以
,其中含碳微粒以![]() 、
、![]() 为主
为主
B.除去NaCl溶液中![]() 的方法是向其中加入盐酸至
的方法是向其中加入盐酸至![]()
C.![]() 的溶液中
的溶液中![]()
![]()
D.将![]() 通入NaOH溶液制取
通入NaOH溶液制取![]() ,应大约控制
,应大约控制![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯氧乙醇是护肤产品中常用的一种有机物,下图是利用烃M和苯酚为主要原料制备苯氧乙醇的合成路线,请回答相关问题。
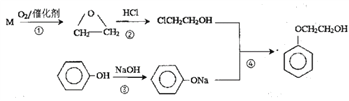
(1)反应①中M与氧气的物质的量之比为2:1且原子利用率为100%,则M的结构简式是_______________,反应①的反应类型是___________________。
(2)ClCH2CH2OH的名称是_____________________。
(3)苯氧乙醇中含有的官能团是___________________,分子式是___________________。
(4)苯酚除了与氢氧化钠反应外也可以与碳酸钠反应生成苯酚钠,该反应的化学方程式是_____________
(5)苯氧乙醇的同分异构体中符合下列要求的有__________种(不考虑一个碳原子上连两个羟基的情况)。
a.属于芳香化合物且苯环上有奇数个取代基
b.能与钠反应生成氢气且只含有一种官能团
其中核磁共振氢谱中峰的数目最少的结构简式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知AX3的熔点和沸点分别为-93.6℃和76℃。在常温常压条件下,AX3与X2气体反应生成1molAX5固体,放出热量123.8kJ。该反应的热化学方程式为_______________。
(2)在25℃、101kPa下,一定质量的无水乙醇(C2H5OH)完全燃烧时放出热量QkJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100gCaCO3沉淀,则乙醇燃烧的热化学方程式为_______________。
(3)NaBH4(s)与H2O(l)反应生成NaBO2(s)和氢气,在25℃、101kPa下,已知每消耗3.8gNaBH4(s)放热21.6kJ,该反应的热化学方程式是_______________。
(4)化学反应中放出的热能(焓变,ΔH)与反应物和生成物的键能(E)有关。已知:E(H—H)=436kJmol-1,E(Cl—Cl)=243kJmol-1,E(H—Cl)=432kJmol-1。则H2(g)+Cl2(g) =2HCl(g) ΔH=_______________。
(5)如图是N2(g)和H2(g)反应生成2molNH3(g)过程中能量变化的示意图,请计算每生成1molNH3(g)放出热量为_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-ΔΗ>0,下列叙述正确的是( )
H++OH-ΔΗ>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体NaOH,平衡逆向移动,c(OH-)降低
D.向水中加入少量固体NaCl,pH变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com