
【题目】用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)准确称取5.0g烧碱样品,所用主要仪器有药匙、烧杯、___。
(2)将样品配成250mL待测液需要的仪器有烧杯、玻璃棒、胶头滴管、___。
(3)取10.00mL待测液,用___量取。
(4)用0.2000mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视___,直到滴定达到终点。
滴定次数 | 待测液的体积/mL | 标准盐酸体积 | |
滴定前读数/mL | 滴定后读数/mL | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(5)根据上述各数据,计算烧碱的纯度:___。
【答案】托盘天平 250mL容量瓶 碱式滴定管 锥形瓶内溶液颜色的变化 80.00%
【解析】
(1)(2)考察配制一定物质的量浓度的溶液的操作;(3)(4)(5)主要考察酸碱滴定;整体不难,根据所学知识答题即可。
(1)称取烧碱固体,需要使用药匙、烧杯、托盘天平;
(2)配制250mL待测液需要的仪器有烧杯、玻璃棒、胶头滴管、250mL容量瓶;
(3)取10.00mL待测液——NaOH溶液,要用碱式滴定管量取;
(4)在滴定时,两眼要注视锥形瓶内溶液颜色的变化;
(5)V(HCl)1=20.40mL-0.50mL=19.90mL,V(HCl)2=24.10mL-4.00mL=20.10mL,所以V(HCl)=![]() =
=![]() =20.00mL,则10.00mL待测液中,n(NaOH)=c(HCl)×V(HCl)= 0.2000mol·L-1×0.02L=0.004mol,所以250mL的待测液中,NaOH的物质的量为
=20.00mL,则10.00mL待测液中,n(NaOH)=c(HCl)×V(HCl)= 0.2000mol·L-1×0.02L=0.004mol,所以250mL的待测液中,NaOH的物质的量为![]() =0.1mol,即5.0g烧碱样品中的NaOH质量为0.1mol×40g·mol-1=4.0g,所以烧碱样品的纯度为
=0.1mol,即5.0g烧碱样品中的NaOH质量为0.1mol×40g·mol-1=4.0g,所以烧碱样品的纯度为![]() =80.00%。
=80.00%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10L的密闭容器中充入1mol X和1mol Y进行反应:2X(g)+Y(g)![]() Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
A.X的平衡转化率为40%
B.若将容器体积变为20L,则Z的平衡浓度小于原来的![]()
C.若增大压强,则Y的平衡转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用pH=m的盐酸滴定20mL pH=n的MOH溶液,且m+n=14。混合溶液的pH与盐酸体积V的关系如图所示。下列说法正确的是( )
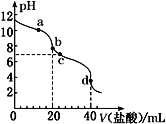
A.a点:c(Cl-)>c(M+)>c(OH-)>c(H+)
B.b点:MOH和HCl恰好完全反应
C.c点:c(H+)=c(OH-)+c(MOH)
D.a点到d点:水电离的c(H+)·c(OH-)先变大,后变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个电化学过程的示意图,请回答下列问题:

(1)图中甲池是_________ (填“原电池” “电解池”或“电镀池”)。
(2)A(石墨)电极的名称是_________ (填“正极” “负极” “阴极”或“阳极”)
(3)写出通入CH3OH的电极的电极反应式________________
(4)乙池中反应的化学方程式为__________________。当乙池中B(Ag)极质量增加54g,甲池中理论上消耗O2的体积为____L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.用铝粉和NaOH溶液反应制取少量H2 Al+2OH-=AlO2-+H2↑
B.电解饱和食盐水制备Cl2 2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C.向氢氧化钡溶液中加入稀硫酸 Ba2++OH-+H++ SO42-=BaSO4↓+H2O
D.向碳酸氢铵溶液中加入足量石灰水 Ca2++HCO3-+OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1).写出CH3CH=CHCH3这种烯烃的顺、反异构体的结构简式:_________、___________。
(2).某芳香烃的分子式为C8H10,它可能有的同分异构体共 _____种,其中__________(结构简式)在苯环上的一溴代物只有两种
(3).写出乙醇在浓硫酸的作用下,加热到170℃时发生的反应方程
式 ________________________________________________________________ 。
(4).化合物X与异戊二烯具有相同的分子式,与Br2/CCl4反应后得到3-甲基-1,1,2,2-四溴丁烷。X的结构简式为_______________。
(5).某有机物由C、H、O三种元素组成,它的红外吸收光谱表明有羟基和烃基上的C—H键的红外吸收峰,且烃基与羟基上的氢原子个数之比为2:1,升温使其汽化,测其密度是相同条件下H2的31倍。该有机物的结构简式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在密闭容器反应,达到平衡状态的标志是()
2NO+O2在密闭容器反应,达到平衡状态的标志是()
(1)单位时间内生成n mol O2的同时生成2n mol NO2
(2)单位时间内生成n mol O2的同时生成2n mol NO
(3)用NO2、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态.
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲、乙、丙、丁四种有机物说法正确的是( )

A. 甲、乙、丙、丁中加入NaOH的醇溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,均有沉淀生成
B. 甲中加入NaOH的水溶液共热,再滴入AgNO3溶液,可检验该物质中含有的卤素原子
C. 乙发生消去反应得到两种烯烃
D. 丙与NaOH的水溶液共热,反应后生成的醇能被氧化为醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与叙述正确的是

A.图甲表示用0.1000mol/L的NaOH溶液滴定20.00ml,0.1000mol/L的醋酸溶液得到的滴定曲线
B.图乙表示压强对可逆反应2A (g)+ B (g)![]() 3C (g)+D (s)的影响且甲的比乙的压强大
3C (g)+D (s)的影响且甲的比乙的压强大
C.图丙表示可逆反应Fe3+(aq)+SCN-(aq)![]() Fe(SCN)2+(aq)平衡时,物质的量浓度 [Fe(SCN) 2+]与温度T的关系,反应处于D点时,一定有v(正)>v(逆)
Fe(SCN)2+(aq)平衡时,物质的量浓度 [Fe(SCN) 2+]与温度T的关系,反应处于D点时,一定有v(正)>v(逆)
D.图丁所示装置可证明溴与苯发生取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com