
【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ加入CO0.8mol、Cl20.8mol,达到平衡时CO转化率大于80%
【答案】C
【解析】
A.容器I中前5min的平均反应速率v(COCl2)= =0.32mol/Lmin-1,依据速率之比等于计量系数之比,则V(CO)=V(COCl2)=0.32mol/Lmin-1,故A错误;
=0.32mol/Lmin-1,依据速率之比等于计量系数之比,则V(CO)=V(COCl2)=0.32mol/Lmin-1,故A错误;
B.依据图中数据可知:Ⅱ和Ⅲ为等效平衡,升高温度,COCl2物质的量减小,说明平衡向逆向移动,则逆向为吸热反应,正向为放热反应,故B错误;
C.依据方程式:CO(g)+Cl2(g)C0Cl2(g),可知:
CO(g)+Cl2(g)C0Cl2(g)
起始浓度(mol/L) 2 2 0
转化浓度(mol/L)1.6 1.6 1.6
平衡浓度(mol/L)0.4 0.4 1.6
反应平衡常数K=![]() =10,平衡时CO转化率:
=10,平衡时CO转化率:![]() ×100%=80%;
×100%=80%;
依据Ⅱ中数据,结合方程式可知:
CO(g)+Cl2(g)C0Cl2(g)
起始浓度(mol/L) 2 2a 0
转化浓度(mol/L) 1 1 1
平衡浓度(mol/L) 1 2a-1 1
Ⅰ和Ⅱ温度相同则平衡常数相同则:K=![]() =10,解得:a=0.55mol,故C正确;
=10,解得:a=0.55mol,故C正确;
D.CO(g)+Cl2(g)C0Cl2(g)为气体体积减小的反应,若起始时向容器I加入CO0.8mol,Cl20.8mol,相当于给体现减压,减压平衡向系数大的方向移动,平衡转化率降低,小于80%,故D错误;
故答案为C。


科目:高中化学 来源: 题型:
【题目】已知化学反应的热效应只与反应物的初始状态和生成物的最终状态有关,下列各反应热关系中不正确的是( )

A. A→F ΔH=-ΔH6
B. A→D ΔH=ΔH1+ΔH2+ΔH3
C. ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0
D. ΔH1+ΔH6=ΔH2+ΔH3+ΔH4+ΔH5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列常用物质:
A.碳酸氢钠 B.阿斯匹林 C.葡萄糖 D.苯甲酸钠 E.柠檬黄
请用字母填空:
①具有解热镇痛疗效的是________,②可直接进入人体血液补充能量的是________,③可用作食品防腐剂的是________,④常用作食品着色剂的是________,⑤常用作治疗胃酸过多的抗酸剂的是________。
(2)保护环境,人人有责。
①空气质量监测中,不需要监测的指标是_________。
A.可吸入颗粒物的含量 B.NO2浓度 C.SO2浓度 D.CO2浓度
②在处理产生的废水时,需先加入明矾,其作用是____________;后通入氯气或二氧化氯,其作用是______________。
③对垃圾需要分类处理。如图所示的垃圾分类标志的含义是___________。

(3)化学与材料密切关联。
①石墨烯(如图)可用作太阳能电池的电极,这里主要利用了石墨烯的________性。

②钢铁在酸雨中会发生电化学腐蚀,请举一例钢铁防腐措施____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明溶液中:Ca2+、Cu2+、Br-、Cl-
B. 能使酚酞变红的溶液中:K+、Na+、CO![]() 、AlO2-
、AlO2-
C. c(ClO-)=1mol·L-1的溶液中:Fe2+、Al3+、NO3-、I-
D.  =0.1mol·L-1的溶液中:NH4+、Mg2+、SO42-、CH3COO-
=0.1mol·L-1的溶液中:NH4+、Mg2+、SO42-、CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.合成氨生产中,使用高效催化剂可提高原料平衡转化率
B.铁质管道与锌用导线相连(如图所示)可防止管道被腐蚀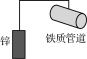
C.除去溴化钠溶液中混有的碘化钠:向溶液中加入稍过量溴水,充分反应后,加入四氯化碳,振荡后静置、分液,取上层溶液
D.合成氨生产中,将氨气液化分离,可加快正反应速率,提高H2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HNO2 | H2S | H2SO3 | H2C2O4 | H2CO3 |
电离平衡常数(25℃) | K=1.8×10-4 | K=5.1×10-4 | K1=9.1×10-8 K2=1.1×10-12 | K1=1.23×10-2 K2=6.6×10-8 | K1=5.4×10-2 K2=5.4×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
(1)上表的6种酸进行比较,酸性最弱的是:___;HCOO-、S2-、HSO3-3种离子中,最难结合H+的是___。
II.已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)两溶液中c(H+)·c(OH-)=___。
(2)各取5mL上述溶液,分别加水稀释至50mL,pH较大的是__溶液。
(3)各取5mL上述溶液,分别加热到90℃,pH较小的是___溶液。
(4)两溶液中由水电离出的c(H+)分别为:H2SO4溶液___;NH4Cl溶液__。
(5)取5mLNH4Cl溶液,加水稀释至50mL,c(H+)___10-6mol·L-1(填“>”、“<”或“=”),![]() __(填“增大”、“减小”或“不变”)
__(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于同分异构体判断正确的是( )
A.二氯甲烷有两种同分异构体
B.分子式为C8H10的芳香烃有3个,分别为 、
、 和
和![]()
C.分子式为C4H8的烯烃同分异构体有2个,分别为CH2=CHCH2CH3、CH3CH=CHCH3
D.分子式为C2H6O的同分异构体有两个,分别是H3C-O-CH3和CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是( )
A. H2SO3的电离方程式:H2SO3![]() 2H++SO32-
2H++SO32-
B. NaHSO4在水溶液中的电离方程式: NaHSO4= Na++H++SO42-
C. Na2CO3的水解∶CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. NH4Cl的水解:NH4++H2O = NH3·H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法错误的是
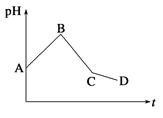
A.阳极先析出Cl2,后析出O2,阴极先产生Cu,后析出H2
B.AB段阳极只产生Cl2,阴极只产生Cu
C.BC段表示在阴极上是H+放电产生了H2
D.CD段相当于电解水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com