
【题目】钛被称为继铁、铝之后的第三金属,制备金属钛的一种流程如下:

回答下列问题:
(1)基态钛原子的价电子排布图为___________________,其原子核外共有_____种运动状态不相同的电子。金属钛晶胞如下图2所示,为________________堆积(填堆积方式)。
(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l-l >> l-b > b-b(l为孤对电子对,b为键合电子对),则关于H2O中的H-O-H键角可得出的结论是________。
A.180° B.接近120°,但小于120°
C.接近120°,但大于120° D.接近109°28’,但小于109°28’
(3)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃,可知TiCl4为______晶体。
(4)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如下图1。化合物乙的沸点明显高于化合物甲,主要原因是___________________________。化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为__________________。

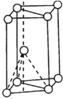
图1 图2
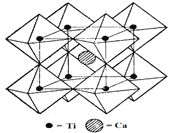
(5)钙钛矿晶体的结构如右图所示。钛离子位于立方晶胞的角顶,被_______个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被__________个氧离子包围。钙钛矿晶体的化学式为_______。若该晶胞的边长为a pm,则钙钛矿晶体的密度为______________g.cm-3(只要求列算式,不必计算出数值)。
【答案】 ![]() 22 六方最密 D 分子 化合物乙分子间形成氢键 N>O>C 6 12 CaTiO3
22 六方最密 D 分子 化合物乙分子间形成氢键 N>O>C 6 12 CaTiO3 ![]()
【解析】(1)钛为22号元素,基态电子排布式为:[Ar]3d24s2,则基态钛原子的价电子排布图为![]() 。基态原子不可能存在运动状态相同的电子,所以Ti有22个不同运动状态的电子。图2的堆积方式对应的是六方最密堆积。
。基态原子不可能存在运动状态相同的电子,所以Ti有22个不同运动状态的电子。图2的堆积方式对应的是六方最密堆积。
(2)H2O中的O原子为sp3杂化,所以∠H-O-H应该接近109°28′,根据价层电子对之间的斥力大小顺序:l-l>>l-b>b-b(l为孤对电子对,b为键合电子对),∠H-O-H的两个电子对都是键合电子对,所以斥力最小,应有∠H-O-H<109°28′,选项D正确,
(3)因TiCl4在常温下是无色液体,熔点、沸点都比较低,由此可判断TiCl4是由共价键结合的分子,晶体类型属于分子晶体。
(4)化合物乙的沸点明显高于化合物甲,主要原因是化合物乙分子间形成氢键。化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为N>O>C,原因是同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素大于相邻元素(半满的稳定结构),所以这三种元素第一电离能从大到小顺序是:N>O>C。
(5)根据晶胞结构图可知,在晶胞中氧离子分布在立方体的棱心,被四个立方体共用,所以氧离子数为12×1/4=3,钛离子分布在立方体的八个顶点,每个钛离子被八个立方体所共用,所以钛离子数为8×1/8=1,钙离子分布在立方体的体心,所以钙离子数为1,钛离子位于立方晶胞的角顶,被6个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被12个氧离子(12个棱心)包围。据此可以确定化学式为CaTiO3。一个晶胞中有一个CaTiO3,质量为136/NA g。晶胞的体积为(a×10-10)3 cm3,所以密度为![]() g.cm-3。
g.cm-3。


科目:高中化学 来源: 题型:
【题目】对于实验IIV的实验现象预测正确的是( ) 
A.实验Ⅰ:逐滴滴加盐酸时,试管中立即产生大量气泡
B.实验Ⅱ:充分振荡后静置,下层溶液为橙红色,上层无色
C.实验Ⅲ:从饱和食盐水中提取NaCl晶体
D.装置Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】F(4-苯并呋喃乙酸)是合成神经保护剂依那朵林的中间体,某种合成路线如下:

(1)化合物F中的含氧官能团为_________和___________(填官能团的名称)
(2)试剂X分子式为C2H3OCl,分子中既无甲基也无环状结构且可发生银镜反应,则X的结构简式为__________;由E→F的反应类型为___________。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式____________。
Ⅰ. 能发生银镜反应 Ⅱ. 分子中含有1个苯环且有3种不同化学环境的氢
(4)借鉴由C到D的合成机理,请写出以![]() 和BrCH2COOC2H5为原料制备
和BrCH2COOC2H5为原料制备![]() 的合成路线流程图(无机试剂可任选)_____。
的合成路线流程图(无机试剂可任选)_____。
合成路线流程图示例如下:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是 ( )
A. 碳酸钙受热分解中生成物总能量高于反应物总能量
B. 物质发生化学反应都伴随着原子的变化
C. 化学键的断裂和形成是化学反应中能量变化的根本原因
D. 化学反应必然伴随能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室收集①一氧化氮、②二氧化氮两种气体,下列收集方法正确的是( )
A. ①和②都用排水法
B. ①和②都用向上排空气法
C. ①用向上排空气法,②用排水法
D. ①用排水法,②向上排空气法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同条件下,质量相等的石墨和金刚石在充分燃烧,石墨放出的热量比金刚石少。据此判断,下列说法正确的是 ( )
A. 由石墨制备金刚石是吸热反应;石墨比金刚石更稳定
B. 由石墨制备金刚石是吸热反应;金刚石比石墨更稳定
C. 由石墨制备金刚石是放热反应;石墨比金刚石更稳定
D. 由石墨制备金刚石是放热反应;金刚石比石墨更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分氧化的Fe﹣Cu合金样品(氧化产物为Fe2O3、CuO)共2.88g,经如下处理: 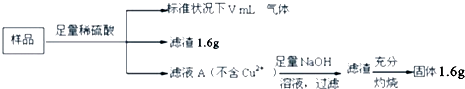
下列说法错误的是( )
A.滤液A中不含Fe3+
B.样品中含氧元素的物质的量为0.01mol
C.上图中V=112
D.溶解样品的过程中消耗的硫酸的总的物质的量为0.02mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.
(1)加入NaOH20~200mL时发生反应离子方程式;加入NaOH200~240mL时发生反应离子方程式 .
(2)镁和铝的总质量为g.
(3)硫酸的物质的量浓度为 .
(4)生成的氢气在标准状况下的体积为L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Cu、Fe2O3、的混合物中加入300mL 1mol/L的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+原混合物中Cu的质量为( )
A.9.6g
B.6.4g
C.3.2g
D.1.6g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com