
【题目】有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定。
(1)岩脑砂的制备

①写出装置B中反应的化学方程式:_____________________________。
②装置C的仪器名称是_____________,装置F的作用是______________________。
③为了使氨气和氯(在D中充分混合,上述装置的合理连接顺序:_______→e f←_______(用小写字母和箭头表示,箭头方向与气流方向一致)。
④证明氨气和氯气反应有NH4Cl生成,需要的检验试剂中除了蒸馏水、稀硝酸、硝酸银溶液、红色石蕊试纸外,还需要_______________________。
(2)岩脑砂中元素的测定
准确称取ag岩脑砂,与足量的氧化铜混合加热
(发生的反应为:2NH4Cl+3CuO![]() 3Cu+N2↑+2HC1+3H2O),利用下列装置测定岩脑砂中氮元素和氯元素的物质的量之比。
3Cu+N2↑+2HC1+3H2O),利用下列装置测定岩脑砂中氮元素和氯元素的物质的量之比。

①装置H中盛装的试剂是_____________,其作用是_____________________。
②若装置I增重bg,利用装置K测得气体体积为V L(已知常温常压下气体摩尔体积为24.5L·mol-l),则岩脑砂中n(N)∶n(Cl)=_________(用含b、V 的代数式表示,不必化简)
③若取消J装置(其它装置均正确),n(N)∶n(Cl)比正常值________(填“偏高”“偏低”或“无影响”)。
【答案】 4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O 干燥管 除去氯气中的氯化氢 a→dc hg←ji←b NaOH溶液 浓硫酸 吸收混合气体中的水蒸气
MnCl2+Cl2↑+2H2O 干燥管 除去氯气中的氯化氢 a→dc hg←ji←b NaOH溶液 浓硫酸 吸收混合气体中的水蒸气 ![]() ∶
∶![]() 偏低
偏低
【解析】(1)①装置B中用二氧化锰氧化浓盐酸制取氯气,反应的化学方程式:4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O;②装置C干燥氯气,仪器名称是干燥管,装置F的作用是除去氯气中的氯化氢。③为了使氨气和氯(在D中充分混合,上述装置的合理连接顺序: a→dc→e f←hg←ji←b(用小写字母和箭头表示,箭头方向与气流方向一致)。④证明氨气和氯气反应有NH4Cl生成,需要的检验试剂中除了蒸馏水、稀硝酸、硝酸银溶液、红色石蕊试纸外,检验铵根离子还需要NaOH溶液。(2)①装置H中盛装的试剂是浓硫酸,其作用是吸收混合气体中的水蒸气。②装置I吸收HCl增重bg,利用装置K测得气体氮体体积为V L(已知常温常压下气体摩尔体积为24.5L·mol-l),则岩脑砂中n(N)∶n(Cl)=.
MnCl2+Cl2↑+2H2O;②装置C干燥氯气,仪器名称是干燥管,装置F的作用是除去氯气中的氯化氢。③为了使氨气和氯(在D中充分混合,上述装置的合理连接顺序: a→dc→e f←hg←ji←b(用小写字母和箭头表示,箭头方向与气流方向一致)。④证明氨气和氯气反应有NH4Cl生成,需要的检验试剂中除了蒸馏水、稀硝酸、硝酸银溶液、红色石蕊试纸外,检验铵根离子还需要NaOH溶液。(2)①装置H中盛装的试剂是浓硫酸,其作用是吸收混合气体中的水蒸气。②装置I吸收HCl增重bg,利用装置K测得气体氮体体积为V L(已知常温常压下气体摩尔体积为24.5L·mol-l),则岩脑砂中n(N)∶n(Cl)=. ![]() ∶
∶![]() ;③J防止K中水蒸气进入H中,若取消J装置(其它装置均正确),测到的HCl偏多,n(N)∶n(Cl)比正常值偏低。
;③J防止K中水蒸气进入H中,若取消J装置(其它装置均正确),测到的HCl偏多,n(N)∶n(Cl)比正常值偏低。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】关于氢键,下列说法正确的是( )
A. 含氢元素的化合物中一定有氢键
B. 氢键比分子间作用力强,所以它属于化学键
C. DNA中的碱基互补配对是通过氢键来实现的
D. H2O是一种非常稳定的化合物,这是由于氢键所致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入______溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用如图装置来测定过氧化钠的质量分数。
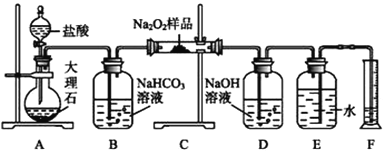
①将仪器连接好以后,必须进行的第一步操作是____________________________________。
②B装置出来的气体是否需要干燥______(填“是”或“否”)。
③D中NaOH溶液的作用____________________。
④实验结束时,读取实验中生成气体的体积时,不合理的是__________。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑤读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为_____________。
⑥实验完成后E到F之间导管内残留水的体积会使测量结果________(填“偏大”“偏小”或“不影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的无机化工产品,合成氨工业对国民经济和社会发展具有重要的意义。其原理如下:N2(g)+3H2(g)![]() 2NH3 (g)ΔH<0。在恒温恒容密闭容器中进行合成氨反应,各组分浓度与时间的关系如图所示。
2NH3 (g)ΔH<0。在恒温恒容密闭容器中进行合成氨反应,各组分浓度与时间的关系如图所示。
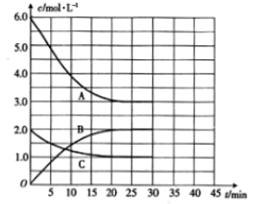
(1)表示N2浓度变化的曲线是___________(填字母),25min时c(NH3)=_________。
(2)0~25min内,用H2浓度变化表示的化学反应速率是_______________。
(3)此温度下,上述反应的平衡常数K的数值为_________________。
(4)若升高温度,则平衡向___________(填“正反应”或“逆反应”)方向移动;正反应速率_____(填“增大”“减小”或“不变”,下同),逆反应速率__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应,会生成橙黄色的易爆物二氧化氯(ClO2)气体,该反应的化学方程式为2KClO3+4HCl(浓) === 2KCl + 2ClO2↑+ Cl2↑+ 2H2O。
(1)该反应中还原产物与氧化产物的物质的量之比为_________________。
(2)若该反应中有490克KClO3参加反应,则被氧化的HCl的质量为______________。
(3)若该反应产生2.24L(标准状况)ClO2,则转移的电子数目为_____________。
(4)某地生产的食盐氯化钠中含有少量的剧毒物质氰化钠(NaCN),用ClO2可除去其中的氰化钠,从而得到纯净的食盐,同时产生两种无毒气体。写出该反应的化学方程式: ______________________。
(5)用双线桥法表示下列氧化还原反应的电子转移情况:____________________
2KClO3+4HCl(浓) === 2KCl + 2ClO2↑+ Cl2↑+ 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中,反应aA(g)+bB(g)![]() cC(g)+dD(g)达平衡时,B的浓度为0.6mol/L,若保持温度不变,将容器的容积扩大到原来的3倍,达新平衡时B的浓度降为0.3mol/L.下列判断正确的是
cC(g)+dD(g)达平衡时,B的浓度为0.6mol/L,若保持温度不变,将容器的容积扩大到原来的3倍,达新平衡时B的浓度降为0.3mol/L.下列判断正确的是
A. a+b<c+d
B. 平衡向正反应方向移动
C. D的体积分数减小
D. 达到新平衡时,A、B的浓度减小,C、D浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学一选修5:有机化学基础】由羧酸A (C3H4O2) 经过如下合成路线获得药物中间体H。
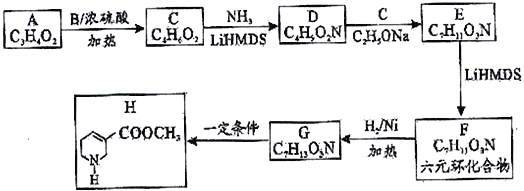
已知:Ⅰ.R1CH=CH1+RNH2 ![]() R1CH2CH2NHR(R可以是氢原子或烃基)
R1CH2CH2NHR(R可以是氢原子或烃基)
Ⅱ.R1COOR2+R3CH2COOR4![]()
![]() +R2OH
+R2OH
请回答:
(1)化合物A 的名称_________________,B的结构简式_______________。
(2)写出药物中间体H中两种官能团的名称_______________________。
(3)已知D的结构简式:H2N-CH2-CH2-COOCH3,D→E的反应类型________________,F→G的反应类型_________________。
(4)写出E→F的化学方程式______________________________________。
(5)写出化合物D符合下列条件的所有可能的同分异构体的结构简式_______(任写两种即可)
①分子中含六元环。
②红外光谱显示分子中含有碳氮单键。
③核磁共振氢谱显示分子中有3种化学环境不同的氢原子。
(6)设计由乙酸甲脂合成聚合物:![]() 的单体的合成路线(其他试剂任选)。(用流程图表示)____________________________。
的单体的合成路线(其他试剂任选)。(用流程图表示)____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应最终没有固体析出的是( )
A.向NaHCO3溶液中加入过量澄清石灰水
B.向饱和氢氧化钠溶液中加入钠单质
C.向氯化钡溶液中通入少量SO2
D.向饱和碳酸钠溶液中通入过量CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的是
A. ①③⑤⑦⑧ B. ②④⑦ C. ①⑥ D. ②④⑥⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com