
 (1)已知甲醇在常温下为液体,其热值为22.7kJ?g-1,则甲醇的标准燃烧热的热化学方程式为
(1)已知甲醇在常温下为液体,其热值为22.7kJ?g-1,则甲醇的标准燃烧热的热化学方程式为| 3 |
| 2 |
| 3 |
| 2 |


科目:高中化学 来源: 题型:
| A、增加氮气的量,平衡正向移动,上式中△H增大 |
| B、增大压强,平衡正向移动,平衡常数增大 |
| C、升高温度,平衡逆向移动,正反应速率增大 |
| D、加入催化剂,反应速率增大,氢气转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△S>0 |
| B、逆向能自发进行,且反应速率和平衡常数均较大 |
| C、反应物总能量大于生成物总能量 |
| D、在任何温度下都不能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 -OH与 -OH与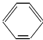 -CH2OH互为同系物 -CH2OH互为同系物 |
| B、乙醇和乙醚互为同分异构体 |
| C、乙醇、乙二醇、丙三醇互为同系物 |
| D、可用浓溴水来区分乙醇苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
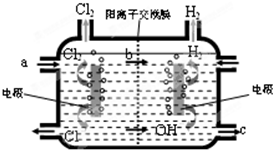
 如图,通电5min后,电极5质量增加2.16g,回答:
如图,通电5min后,电极5质量增加2.16g,回答:查看答案和解析>>
科目:高中化学 来源: 题型:
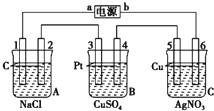
 将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物.
将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
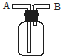
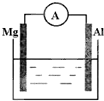 如图所示,组成一个原电池.
如图所示,组成一个原电池.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com