
(1)下列物质:①石墨 ②三氧化硫 ③液态氯化氢 ④氯气 ⑤熔融的硫酸钾 ⑥食盐晶体 ⑦硫酸溶液 ⑧乙醇 ⑨冰醋酸 ⑩NH3·H2O,其中能够导电的是 ,强电解质是 ,弱电解质是 ,非电解质是 。
(2)H2S溶于水的电离方程式为 。
①向H2S溶液中加入CuSO4溶液时,电离平衡向 移动,c(H+) ,c(S2-) 。
②向H2S溶液中加入NaOH固体时,电离平衡向 移动,c(H+) ,c(S2-) 。
③若将H2S溶液加热至沸腾,c(H2S) 。
④若要增大H2S溶液中c(S2-),最好加入 。
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:填空题
(15分)锗及其某些化合物是导弹火箭制导中的重要光电材料,工业上生产锗的流程如下:
已知:GeO2与浓盐酸反应生成四氯化锗(熔点为—51.5℃,沸点为86.6℃)。四氯化锗易水解。
(1)步骤②中浓盐酸除了作为反应物外,还有一个重要作用是 。
(2)步骤③控制的温度范围 。
(3)写出反应的④、⑥的化学方程式
④ ;⑥ 。
(4)生产过程中可以循环利用的物质是 (填化学式)
(5)步骤①中产生的SO2可以用碱液吸收,请写出离子反应方程式 。
(6)请简要描述实验室中操作a的过程 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知溶液中只存在OH-、H+、Na+、CH3COO-四种离子,试回答下列问题:
(1)若溶液中只溶解了一种溶质,则该溶质是 ,溶液中c(H+) c(OH-)(填“>”、“=”或“<”)。
(2)若溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则该溶液中的溶质为 ,若溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则该溶液中溶质为 。
(3)若该溶液是由体积相等的NaOH溶液和醋酸溶液混合而成,且恰好呈中性,则混合前c(NaOH) c(CH3COOH),混合前碱中c(OH-)和酸中c(H+)的关系c(OH-) c(H+)(填“>”,“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
炼金废水中含有络离子[Au(CN)2]-,其电离出的CN-有毒,当CN-与H+结合生成HCN时,毒性更强。回答下列问题。
(1)剧毒物HCN的水溶液酸性很弱,写出其电离的方程式: 。
(2)与弱电解质碳酸的电离方式相似,[Au(CN)2]-也存在着两步电离,其一级电离方程式为 。
(3)处理这种废水是在碱性条件下,利用NaClO将CN-氧化为CO32-和N2,其离子方程式为 。在酸性条件下,ClO-也能氧化CN-,但实际处理废水时却不在酸性条件下进行的主要原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适的氧化剂,使Fe2+被氧化为Fe3+,下列物质可采用的是________。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A.NaOH B.KOH C.CuO D.Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4不一定能达到除去Fe3+而不损失Cu2+的目的。乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常残留在溶液中的离子浓度小于1×10-5mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________。(填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有0.1 mol/L的盐酸溶液(a)、硫酸溶液(b)、醋酸溶液(c)各50 mL,试比较:
(1)三种酸的氢离子浓度由大到小的顺序是________(填字母代号,下同);三种酸的pH由大到小的顺序是________。
(2)三种酸跟足量的锌反应,开始时产生H2的速率由大到小的顺序是________。(不考虑Zn的纯度及表面积等因素)
(3)三种酸跟足量的锌反应产生H2的体积由大到小的顺序是________。
(4)三种酸分别跟0.1 mol/L的NaOH溶液中和,消耗NaOH溶液体积由大到小的顺序是________。
(5)三种酸分别跟50 mL 0.1 mol/L的NaOH溶液反应后,溶液的pH由大到小的顺序是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈________(填“酸性”、“中性”或“碱性”),溶液中c(Na+)________c(CH3COO-)(填“>”、“=”或“<”)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈________(填“酸性”、“中性”或“碱性”),溶液中c(Na+)________c(CH3COO-)(填“>”、“=”或“<”)。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中CH3COO-和Na+浓度相等,则混合后溶液呈________(填“酸性”、“中性”或“碱性”),醋酸体积________氢氧化钠溶液体积(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)常温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”)。设盐酸中参加反应的Zn粒质量为m1,醋酸溶液中参加反应的Zn粒质量为m2,则m1________m2(选填“<”、“=”或“>”)。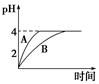
(2)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于________;要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加NaOH溶液,使溶液pH为________。
(3)10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。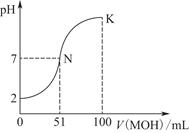
回答下列问题:
(1)由图中信息可知HA为________酸(填“强”或“弱”),理由是________________________________________________。
(2)常温下一定浓度的MA稀溶液的pH=a,则a________________________________________________________7
(填“>”“<”或“=”),用离子方程式表示其原因为_____________________________________________________
此时,溶液中由水电离出的c(OH-)=________。
(3)请写出K点所对应的溶液中离子浓度的大小关系:_________________________________________。
(4)K点对应的溶液中,c(M+)+c(MOH)________2c(A-)(填“>”“<”或“=”);若此时溶液中,pH=10,则c(M+)-c(OH-)=________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com