
 (1)选择下列物质:①MgCl2②金刚石③NH4Cl④KNO3⑤干冰⑥单质碘晶体,按要求填空.(填序号)
(1)选择下列物质:①MgCl2②金刚石③NH4Cl④KNO3⑤干冰⑥单质碘晶体,按要求填空.(填序号)

科目:高中化学 来源: 题型:
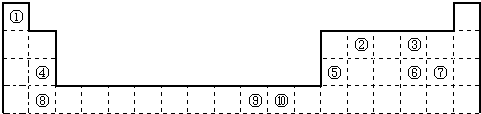
| 电离能I(eV) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、均减少 |
| B、均增大 |
| C、①增大,②不变,③减少 |
| D、①减少,②不变,③增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、OH-、Ba2+、HCO3-、Cl- |
| B、K+、Fe2+、H+、NO3- |
| C、NH4+、Al3+、Cl-、NO3- |
| D、Mg2+、SO42-、SiO32-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 第45届世界体操锦标赛于2014年10月3日至12日在广西体育中心体育馆举行.
第45届世界体操锦标赛于2014年10月3日至12日在广西体育中心体育馆举行.查看答案和解析>>
科目:高中化学 来源: 题型:
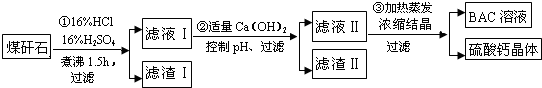
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L0.1mol/LKCl溶液 |
| B、0.2L0.2mol/L的盐酸溶液 |
| C、0.1L0.1mol/L的AlCl3溶液 |
| D、0.3L0.1 mol/L的MgCl2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com