
| A、均减少 |
| B、均增大 |
| C、①增大,②不变,③减少 |
| D、①减少,②不变,③增大 |


科目:高中化学 来源: 题型:
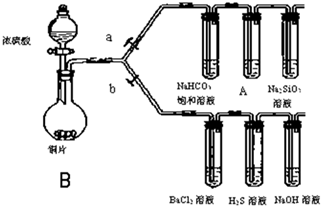 根据要求完成下列各小题实验目的.(如图a、b为弹簧夹,加热及固定装置已略去)
根据要求完成下列各小题实验目的.(如图a、b为弹簧夹,加热及固定装置已略去)| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
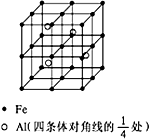 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 实验温度 | c(Na2S2O3)/mol?L-1 | c(H2SO4)/mol?L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 结构,苯环上含有两个取代基,且在核磁共振氢谱中只出现4种峰的所有物质的结构简式为:
结构,苯环上含有两个取代基,且在核磁共振氢谱中只出现4种峰的所有物质的结构简式为:查看答案和解析>>
科目:高中化学 来源: 题型:
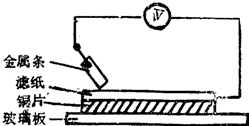 如图所示实验中,把四根洁净的金属条A、B、C、D轮流放置在浸有盐溶液的滤纸上面并压紧.在每次轮流实验时,记录了电压表指针的移动方向和电压表的读数(如下表).下列说法中正确的是( )
如图所示实验中,把四根洁净的金属条A、B、C、D轮流放置在浸有盐溶液的滤纸上面并压紧.在每次轮流实验时,记录了电压表指针的移动方向和电压表的读数(如下表).下列说法中正确的是( )| 金属 | 电子流动方向 | 电压 |
| A | A→Cu | +0.78 |
| B | Cu→B | -2.15 |
| C | C→Cu | +1.35 |
| D | +0.30 |
| A、金属D与Cu之间电子流动方向为Cu→D |
| B、A金属可能是最强的还原剂 |
| C、B金属不能从硫酸铜溶液中置换铜 |
| D、B金属可能是最强的还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
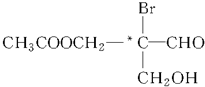 下列有机物分子中带“*”碳原子就是手性碳原子.该有机物分别发生下列反应,生成的有机物分子中含有手性碳原子的是( )
下列有机物分子中带“*”碳原子就是手性碳原子.该有机物分别发生下列反应,生成的有机物分子中含有手性碳原子的是( )| A、与乙酸发生酯化反应 |
| B、在稀硫酸作用下水解 |
| C、与银氨溶液作用发生银镜反应 |
| D、催化剂作用下与H2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)选择下列物质:①MgCl2②金刚石③NH4Cl④KNO3⑤干冰⑥单质碘晶体,按要求填空.(填序号)
(1)选择下列物质:①MgCl2②金刚石③NH4Cl④KNO3⑤干冰⑥单质碘晶体,按要求填空.(填序号)查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+、Na+、Cu2+、Al3+ |
| 阴离子 | SO42-、HCO3-、NO3-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com