
����Ŀ��ij�ȵ糧������õ���ʯ�ࣨCaSO42H2O������K2SO4���ϵ�������ͼ��

��ش��������⣺
��1��ʯ����S�Ļ��ϼ���___���Ի���S2-�����ӽṹʾ��ͼ___����д��������̵Ļ�ѧ����ʽ2CaCO3+2SO2+O2+4H2O��2CaSO42H2O+2__��
��2��ʯ���뱥�ͣ�NH4��2CO3��Һ���ϣ�������Ӧ��ʱ�費�Ͻ��裬��Ŀ����__��
��3��ʵ������ɹ��˲�������Ҫ�õ�����������������������____��
��4���ù��տ���ѭ�����õ�������____������ƷNH4Clũҵ�����п�����___��
���𰸡�+6 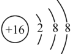 CO2 ʹԭ�ϳ�ַ�Ӧ�����ԭ�������� ���� ̼��� ����
CO2 ʹԭ�ϳ�ַ�Ӧ�����ԭ�������� ���� ̼��� ����
��������
(1)�����������ϼ۵Ĵ�����Ϊ0����S�Ļ��ϼۣ�S2-�ĺ˵����Ϊ16�����⺬��18�����ӣ���Ϻ�����ӵ��Ų����ɻ������ӽṹʾ��ͼ�����������غ㶨�ɷ����жϣ�
(2)���ݽ����ܹ�ʹԭ�ϳɷֻ�Ϸ�����
(3)���ݹ��˲����в����������÷�����
(4)���ݷ�Ӧ�����еķ�Ӧ�������ҳ���ѭ�����õ����ʣ�����NH4Cl����NԪ�ط�����
(1)ʯ��(CaSO42H2O)��Ca�Ļ��ϼ�Ϊ+2�ۣ�H�Ļ��ϼ�Ϊ+1�ۣ�O�Ļ��ϼ�Ϊ-2�ۣ������������ϼ۵Ĵ�����Ϊ0��S�Ļ��ϼ���+6�ۣ�S2-�ĺ˵����Ϊ16�����⺬��18�����ӣ����ӽṹʾ��ͼΪ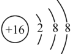 ���������غ㶨�ɣ���Ӧǰ��ԭ�ӵ����༰��Ŀ�����֪��������������Ӧ����������ǣ�CO2���ʴ�Ϊ��+6��
���������غ㶨�ɣ���Ӧǰ��ԭ�ӵ����༰��Ŀ�����֪��������������Ӧ����������ǣ�CO2���ʴ�Ϊ��+6�� ��CO2��
��CO2��
(2)ʯ���뱥��(NH4)2CO3��Һ���ϣ�������Ӧ��ʱ�費�Ͻ��裬����ʹԭ�ϳ�ַ�Ӧ�����ԭ�������ʣ��ʴ�Ϊ��ʹԭ�ϳ�ַ�Ӧ�����ԭ�������ʣ�
(3)ʵ������ɹ��˲�����Ҫ�ò�������������ֹҺ������©���⣬�ʴ�Ϊ��������
(4)ͨ��������Ӧ�����̿�֪���ù��տ���ѭ�����õ�������̼��ƣ�NH4Cl�dz�����һ�ֵ��ʣ��ʴ�Ϊ��̼��ƣ����ʡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������(N2H4)��ˮ��Һ���У�
�� N2H4+H2O![]() N2H5++OH- K1
N2H5++OH- K1
�� N2H5++H2O![]() N2H62++OH- K2 ��
N2H62++OH- K2 ��
����Һ�е��������ʵ���������(X)��-lgc(OH-)�仯�Ĺ�ϵ��ͼ��ʾ�����������������

A. ͼ�Т��Ӧ����ΪN2H62+
B. ��Ӧ��ΪN2H5+��ˮ��ƽ�ⷽ��ʽ
C. ��C��ΪN2H5C1��Һ������ڣ�c(Cl-)>c(N2H5+ )+2c(N2H62+)
D. ��A�����K1=10-6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵķ�����ͼ��ʾ��

��ͼ�ж�����˵���в���ȷ���ǣ� ��
A.��ͼ��ʾ�ķ����������״���෨
B.��ͼ��ʾ�ķ�������ڽ�����෨
C.����������һ���ǽ���������
D.�ǽ���������һ ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӹ�ǰ��������Խ������������������ϴ���������ϴ��ˮ��pH��2���ҵ�ij���Է�ˮ����Ԫ����������Լ3%����������Ԫ����ͭ������пŨ�Ƚϵͣ��ۺ�������ϴ��ˮ���Ʊ����Ȼ������Ʊ��������£�

��ؽ������������������������pH���±���
Fe(OH)3 | Cu(OH)2 | Ni(OH)2 | Zn(OH)2 | |
��ʼ������pH | 1.5 | 4.2 | 7.1 | 5.4 |
������ȫ��pH | 3.7 | 6.7 | 9.2 | 8.0 |
�ش��������⣺
(1)���к͡�ʱ����pH��________�������ں����Ʊ��ô��ȽϸߵIJ�Ʒ��
(2)������ϴ��ˮ�кͺ��������ʹ��Ԫ�ؽ��������ղ�ͬ�Ĺ�Һ��Ͷ�롰���ˡ���������ҵ������з�Ӧ������������ͼ��ʾ��ʵ�������й�Һ��ѡ��1.5��1��ԭ����__________________��

(3)д�����������з�����Ӧ�����ӷ���ʽ��____________________________________��
(4)�����ܡ����������Һ��Fe2������ȷ����������Ͷ��������K2Cr2O7����Һ�ⶨFe2��(Cr2O![]() ����ԭΪCr3��)�ĺ������÷�Ӧ���ӷ���ʽΪ____________________________��
����ԭΪCr3��)�ĺ������÷�Ӧ���ӷ���ʽΪ____________________________��
(5) �����Ȼ�����Һ��һ��������________��________�����ˡ�ϴ�ӡ����Ȼ��������и����FeCl3��6H2O���壬��ʵ���ҹ���װ����ϴ�ӹ���ķ�����___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɽ���ۺ���P�ĺϳ�·������

��1��A���������������____________��
��2������a�ĵ��뷽����________________��
��3��B��C�Ļ�ѧ����ʽ��_____________��
��4��������D�����ϵ�һ�ȴ�����2�֣�D�Ľṹ��ʽ��___________��
��5��E��F�з�Ӧ�������ķ�Ӧ���ͷֱ���___________��
��6��F�Ľṹ��ʽ��_____________��
��7���ۺ���P�Ľṹ��ʽ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
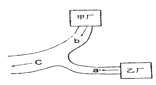
����Ŀ���ס��������������ֲ�����ͼ��ʾλ�ã���ͷ��ָΪ������ˮ����ˮ���������a��ȡ�õ�ˮ�������ֻ��������������ᱵ����c��ȡ�õ�ˮ�������pH=7����ֻ�����������ƣ���b����ˮ�к��е�����Ӧ�����������е�
A. MgSO4��NaCl
B. K2SO4��NaOH
C. KOH��Na2SO4
D. NaOH��Na2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ���������ʵ���Ũ�ȹ�ϵ��ȷ����
A. 25��ʱ����0.1mol��L-1NH4HSO4��Һ�еμ�NaOH��Һ�����ԣ�c��Na+����c(NH4+)��c(SO42-)��c(OH-)=c(H+)
B. 25��ʱ��NaB��Һ��pH=8��c��Na+��- c��B-��=9.9��10-7 mol��L-1
C. 0.1 mol��L-1NaHCO3��Һ��c��Na+����c(oH-)��c(HCO3-)��c(H+)
D. ��ͬ���ʵ���Ũ�ȵ�CH3COONa��NaClO�Ļ��Һ�У�������Ũ�ȵĴ�С��ϵ�ǣ�c��Na+����c(ClO-)��c(CH3COO-)��c(OH-)��c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ����a1 mL b1 mol��L-1 HCl���뵽a2 mL b2 mol��L-1 NH3��H2O�У����н�����ȷ����
A. �����Һ��pH<7����:a1b1=a2b2
B. ��a1=a2�һ��Һ��pH>7����b1<b2
C. ��a1=a2��b1=b2��������Һ��: ![]()
D. ����Ϻ���ҺpH=7��������Һ��: ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������DZ���̼�⻯�����±����������ܳƣ����ƻ�������Ļ�ѧ��Ӧ�������£��Զ��ȶ�������Ϊ�������ȶ�������������Ȼ�̼��������ڴ��������¡����ƻ��������¶�Ϊ��5��ʱ�õ�����
��CF2Cl2![]() CF2Cl+Cl
CF2Cl+Cl
��Cl+O3��ClO+O2
��ClO+ClO��ClOOCl���������ȣ�
��ClOOCl![]() 2Cl+O2
2Cl+O2
����˵���в���ȷ����
A. ������ʹCF2Cl2�ֽ�������dz������������Ĵ���
B. ��Ӧ���е������뷴Ӧ�������ɵ���ԭ�ӻ�ѧ������ͬ
C. ClOOCl�����и�ԭ���������ﵽ8�����ȶ��Y��
D. ��̬�⻯����ȶ��ԣ�HF��H2O��HCl
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com