
【题目】钛酸钡(BaTiO3)是一种强介电化合物,是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶 瓷工业的支柱”。
Ⅰ、固相合成法是钛酸钡的传统制备方法,典型的工艺是将等物质的量的碳酸钡和二氧化钛混合,在1500℃下反应 24 小时。
(1)写出发生反应的化学方程式:_____。
(2)该工艺的优点为工艺简单,不足之处为_____。
Ⅱ、工业上还可以 BaCO3、TiCl4 为原料,采用草酸盐共沉淀法制备草酸氧钛钡晶体[BaTiO(C2O4)24H2O],再高温煅烧制得钛酸钡粉末,其制备工业流程如图所示。
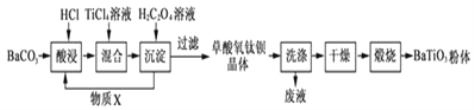
(3)为提高 BaCO3 的酸浸率,可采取的措施为_____ (任答一点)。
(4)加入 H2C2O4 溶液时,可循环使用的物质 X 是_____。
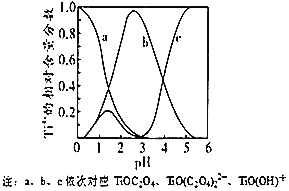
(5)研究表明,钛离子在不同 pH 下可以 TiO(OH)+、TiOC2O4 或 TiO(C2O4)2等形式存在(如图),所以在制备草酸氧钛钡晶体时要用到氨水调节混合溶液的 pH. 请结合图示信息分析,混合溶液的最佳 pH 为_____左右。
(6)高温煅烧草酸氧钛钡晶体[BaTiO(C2O4)24H2O]得到 BaTiO3 的同时,生成高温气体产物有 CO、_____和_____。成都七中某兴趣小组在实验室里模拟“高温煅烧”操作时所使用的陶瓷仪器有_____。
(7)将 TiCl4 水解产物加热脱水可生成 TiO2,写出 TiCl4 水解的化学方程式:_____。
【答案】BaCO3+TiO2![]() BaTiO3+CO2↑ 高温煅烧能耗大,对设备要求高 将碳酸钡固体粉碎、搅拌、适当升温等 HCl 3 CO2 H2O(g) 坩埚、泥三角 TiCl4+(2+x)H2O=TiO2xH2O↓+4HCl
BaTiO3+CO2↑ 高温煅烧能耗大,对设备要求高 将碳酸钡固体粉碎、搅拌、适当升温等 HCl 3 CO2 H2O(g) 坩埚、泥三角 TiCl4+(2+x)H2O=TiO2xH2O↓+4HCl
【解析】
Ⅰ、反应在高温下进行,消耗能源较多,涉及反应为BaCO3+TiO2![]() BaTiO3+CO2↑;
BaTiO3+CO2↑;
Ⅱ、由制备流程可知,碳酸钡与盐酸反应生成氯化钡,然后氯化钡与四氯化碳、草酸反应生成BaTiO(C2O4)24H2O,过滤、洗涤、干燥、煅烧得到BaTiO3,以此解答该题。
Ⅰ、(1)涉及反应为BaCO3+TiO2![]() BaTiO3+CO2↑,
BaTiO3+CO2↑,
故答案为:BaCO3+TiO2![]() BaTiO3+CO2↑;
BaTiO3+CO2↑;
(2)反应在高温下进行,消耗能源较多,对设备要求高,
故答案为:高温煅烧能耗大,对设备要求高;
Ⅱ、(3)为提高 BaCO3 的酸浸率,可将碳酸钡固体粉碎、搅拌、适当升温等,
故答案为:将碳酸钡固体粉碎、搅拌、适当升温等;
(4)酸浸时消耗HCl、生成草酸氧钛钡时生成HCl,所以能循环的物质X是HCl,
故答案为:HCl;
(5)由图象可知pH=3时TiO(C2O4)2含量较高,
故答案为:3;
(6)BaTiO(C2O4)24H2O煅烧,发生分解反应,由元素守恒可知,生成高温下的气体产物有CO、CO2、H2O(g),煅烧时需要坩埚、泥三角等陶瓷仪器,
故答案为:CO2;H2O(g);坩埚、泥三角;
(7)TiCl4水解生成TiO2xH2O,同时生成HCl,水解方程式为:TiCl4+(2+x)H2O=TiO2xH2O↓+4HCl,
故答案为:TiCl4+(2+x)H2O=TiO2xH2O↓+4HCl。


科目:高中化学 来源: 题型:
【题目】常温下,在体积均为20mL、浓度均为0.1mol·L-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)表示为pH水=-lgc(H+)水。pH水与滴加氢氧化钠溶液体积的关系如图所示。
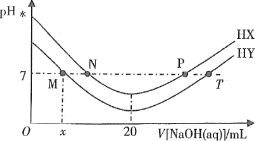
下列推断正确的是
A.HX的电离方程式为HX=H++X-
B.T点时c(Na+)=c(Y-)>c(H+)=c(OH-)
C.常温下用蒸馏水分别稀释N、P点溶液,pH都降低
D.常温下,HY的电离常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题。

(1)打开K2,合并K1。B为___极,A极的电极反应为___。
(2)打开K1,合并K2。E为___极,F极的电极反应为___,
(3)若往U形管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是___,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
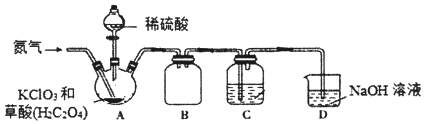
【题目】二氧化氯(C1O2)是一种黄绿色气体,沸点为11℃,不稳定,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。C1O2易溶于水但不与水反应,其水溶液在温度过高时有可能爆炸。某小组按照以下实验装置制备C1O2并验证其某些性质。
请回答下列问题:
(1)实验时A装置需要控制温度为60~80℃,则A装置加热的方式是___,该加热方式的优点是_____。
(2)通入氨气的主要作用有两个,一是可以起到搅拌作用,二是____。
(3)B装置的作用是___。C装置用来吸收C1O2,则C中液体易选用下列___(填序号)。
①热水 ②冰水 ③饱和食盐水
(4)装置D中C1O2与NaOH溶液反应可生成等物质的量的两种钠盐,其中一种为NaClO2,装置C中生成这两种钠盐的化学方程式为____。饱和NaClO2溶液在温度低于38℃时析出晶体NaC1O23H2O,在温度高于38℃时析出晶体NaClO2.请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:a.___;b.___;c.洗涤;d.干燥。
(5)设计一个简易实验证明二氧化氯具有永久的漂白性:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列六种物质的溶液:①NaCl ②NH4Cl ③Na2CO3 ④Al2(SO4)3 ⑤CH3COOH ⑥NaHCO3。
(1)25℃时,0.1mol·L-1②溶液的pH________7(填“>”、“=”或“<”);其原因是_____________(用离子方程式表示);
(2)常温下,浓度均为0.1mol/L的③和⑥的溶液中离子种类________(填“相同”或是“不相同”);
(3)常温下0.1 mol/L的⑤溶液加水稀释过程中,下列表达式的数据一定变大的是_________。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(4)室温下,使用pH计测定0.1 mol/LNH4Cl溶液的pH=5.12。由此可以得到的结论是_______(填字母)。
a.溶液中c(H+)>c(OH-) b.NH4+水解是微弱的
c.NH3·H2O是弱碱 d.由H2O电离出的c(H+)<10-7 mol/L
e.物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7
(5)某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是____,

A.a点导电能力比b点强
B.b点的KW值大于c点
C.与盐酸完全反应时,消耗盐酸体积Va>Vc
D.a、c两点c(H+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚维酮碘的水溶液是一种常用的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如图 ,下列说法不正确的是( )
,下列说法不正确的是( )
A.聚维酮的单体是![]() B.聚维酮分子由(m+n)个单体聚合而成
B.聚维酮分子由(m+n)个单体聚合而成
C.聚维酮碘是一种水溶性物质D.聚维酮在一定条件下能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4是重要的清洁能源和化工原料,CH4和CO2都是产生温室效应的主要气体,且前者影响更大。
(1)二氧化碳的电子式为______________。
(2)25℃、101Kpa下,1g CH4完全燃烧生成液态水和CO2放热55.64kJ,则表示CH4燃烧热的热化学方程式为:__________________________________。
(3)CH4和CO2反应可以生成价值更高的化工产品,在250℃、以镍合金为催化剂,向2L密闭容器中通入4mol CH4和6mol CO2发生反应如下:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。平衡时甲烷的物质的量为1mol。
2CO(g)+2H2(g)。平衡时甲烷的物质的量为1mol。
①计算此温度下,该反应的平衡常数K=_________mol2/L2。
②下列各项不能说明该反应处于平衡状态的是_________。
A.容器中的压强恒定 B CH4的转化率恒定
C.容器中气体的密度恒定 D. CH4与CO物质的量之比恒定
(4)甲烷-空气碱性(KOH为电解质)燃料电池的负极反应式为_________________。相同条件下甲烷燃料电池与氢气燃料电池的能量密度之比为________。(能量密度之比等于单位质量可燃物完全反应转移的电子数之比)
(5)科学家以CO2和H2为原料合成乙烯,6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H20(g),已知温度对CO2平衡转化率和催化剂催化效果的影响如图所示,请回答下列问题:
CH2=CH2(g)+4H20(g),已知温度对CO2平衡转化率和催化剂催化效果的影响如图所示,请回答下列问题:

①生成乙烯的速率:v(M)有可能大于v(N),其理由是_________________。
②若投料比n(H2):n(CO2)=4:1,则图中M点时,C2H4的体积分数为_______%。
③若想提高C2H4的产率,可采取的措施有___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋硝香豆素是一种治疗心脑血管疾病的药物,能阻碍血栓扩展,其结构简式为:
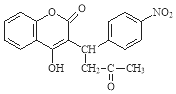
醋硝香豆素可以通过以下方法合成(部分反应条件省略)。

已知: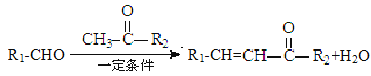
回答以下问题:
(1)反应①的反应类型是______。
(2)从A到B引入的官能团名称是______。
(3)物质C的结构简式为______。
(4)反应③的化学方程式为______。
(5)关于E物质,下列说法正确的是______(填字母序号)。
a 在核磁共振氢谱中有四组吸收峰
b 可以用酸性高锰酸钾溶液鉴别D和E
c 可以发生加成反应、聚合反应、氧化反应和还原反应
d 存在顺反异构
(6)分子结构中只含有一个苯环,且同时符合下列条件的G的同分异构体共有______种。
①可与氯化铁溶液发生显色反应;
②可与碳酸氢钠溶液反应生成二氧化碳气体。其中,苯环上的一氯代物只有两种的同分异构体的结构简式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com