
【题目】已知甲、乙、丙是中学常见的三种气体单质,相互间反应可制得化肥B.其转化关系如图1所示:
(1)将B中所含元素填写在如表的恰当位置中(用元素符号表示)
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ||||||||
2 | ||||||||
3 |
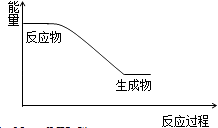
(2)已知反应一是放热反应,画出能量关系示意图.
(3)为加快反应一的速率,可采取的措施有:适当升高温度、选用恰当的催化剂、增大某一反应物的浓度和 .
(4)方法一的化学方程式是 .
(5)用方法二也能制得B:甲和丙反应的产物与A反应即可,这两种方法更好的是(填“方法一”或“方法二”),理由是 .
【答案】
(1)H;N;Cl
(2)
(3)增大压强
(4)3Cl2+8NH3=N2+6NH4Cl
(5)方法二;方法二的原子利用率100%,零排放,符合绿色化学理念
【解析】解:甲、乙、丙是中学常见的三种气体单质,相互间反应可制得化肥B,由转化关系可知,反应一为合成氨,甲、乙分别为氮气、氢气中一种,方法一是氯气与氨气反应生成氯化铵与氮气,丙为氯气、B为NH4Cl.
(1.)B为NH4Cl,含有H元素处于第一周期IA族,N元素处于第二周期VA族,Cl元素处于第三周期ⅦA族,如图所示:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | H | |||||||
2 | N | |||||||
3 | Cl |
所以答案是:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | H | |||||||
2 | N | |||||||
3 | Cl |
;
(2.)反应一是放热反应,则反应物总能量高于生成物总能量,能量关系示意图为:  ,
,
所以答案是:  ;
;
(3.)适当升高温度、选用恰当的催化剂、增大某一反应物的浓度可以加快反应速率,由于有气体参与反应,增大压强,反应速率加快,
所以答案是:增大压强;
(4.)方法一是氯气与氨气反应生成氯化铵与氮气,反应方程式为:3Cl2+8NH3=N2+6NH4Cl,
所以答案是:3Cl2+8NH3=N2+6NH4Cl;
(5.)方法二:甲和丙反应的产物与A反应即可,则甲为氢气、乙为氮气,甲和丙反应的产物为HCl,HCl与氨气反应生成NH4Cl,方法二的原子利用率100%,零排放,符合绿色化学理念,方法二更好,
所以答案是:方法二;方法二的原子利用率100%,零排放,符合绿色化学理念.


科目:高中化学 来源: 题型:
【题目】下列实验操作中,正确的是 ( )
A.利用丁达尔现象区别NaCl溶液和K2SO4溶液
B.用渗析的方法除去胶体中的离子或分子,以净化胶体
C.用滤纸过滤除去溶液中的胶体粒子
D.向煮沸的NaOH溶液中滴加FeCl3溶液可制备Fe(OH) 3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属在生产生活中起着重要作用。
(1)下列金属制品中,利用金属导热性的是________(填字母)。
A. 金属硬币 B. 铝制导线 C. 铜制火锅
(2)金属钯是稀有的贵重金属之一,金属钯制成的首饰不仅有迷人的光彩,而且经得住岁月的磨砺。现有银(Ag)、铂(Pt)、钯(Pd)三种金属制成的戒指,某实验小组利用它们来探究三种金属的活动性。

①把钯戒指放入稀硫酸溶液中,戒指完好无损,可推测钯在金属活动性顺序表中位于铁之________(填“前”或“后”)。
②如图所示,将银、铂戒指分别放入甲、乙两烧杯中,一段时间后取出,发现只有银戒指表面有明显变化。通过该实验判断,银、铂、钯的金属活动性由强到弱顺序为__________。
③如果将钯粉置于盐酸溶液中,边通入氧气边搅拌,钯粉溶解得到二氯化钯(PdCl2)溶液,该反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是( )
A. 虽然固体氯化钠不能导电,但氯化钠是电解质
B. 纯水的pH随温度的升高而减小
C. 在醋酸钠溶液中加入少量氢氧化钠,溶液中c(OH-)增大
D. 在纯水中加入少量硫酸铵,可抑制水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,有关制备途径及性质如图所示.下列说法错误的是( ) 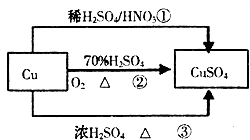
A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2
B.相对于途径①、③,途径②更好地体现了绿色化学思想
C.生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量:①=②<③
D.利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol A气体和2mol B气体在体积为2L的密闭容器中混合,并在一定条件下发生反应:2A(g)+B(g)xC(g),若经2s后测得A的物质的量为2.8mol,C的物质的量浓度为0.6mol/L.现有几种说法:①2s内用物质A表示的平均反应速率为0.3mol/(Ls);②2s内用物质B表示的平均反应速率为0.6mol/(Ls);③2s时物质B的转化率为70%;④x=2.其中正确的是( )
A.①③
B.①④
C.②③
D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com