
【题目】下列叙述中,错误的是( )
A. 虽然固体氯化钠不能导电,但氯化钠是电解质
B. 纯水的pH随温度的升高而减小
C. 在醋酸钠溶液中加入少量氢氧化钠,溶液中c(OH-)增大
D. 在纯水中加入少量硫酸铵,可抑制水的电离
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图表示细胞生物中四种有机物的组成,依据主要功能,分析回答:

(1)A是_________,检测物质A用_________试剂,该试剂与物质A反应出现_________(填现象)。正常情况下,动物细胞中的能分解成单糖补充血糖含量的E是_________,植物细胞中E主要是_________。
(2)F是_________,它是由B(脂肪酸和甘油)形成的;除此之外,脂质还包_________和_________。检测F用_________试剂。
(3)H是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A.离子化合物中不可能存在非极性键
B.含离子键的化合物一定是离子化合物中, 含共价键的化合物不一定是共价化合物
C.共价化合物中一定不含离子键
D.非金属和非金属之间可以形成共价键、也可以形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中的四种物质,用一种试剂即可鉴别的是( )
A.甲酸、乙醛、甲酸钠溶液、乙酸乙酯
B.乙烯、乙烷、乙炔、丙烯
C.苯酚、乙醇、苯、四氯化碳
D.苯乙烯、苯酚、乙苯、甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙是中学常见的三种气体单质,相互间反应可制得化肥B.其转化关系如图1所示:
(1)将B中所含元素填写在如表的恰当位置中(用元素符号表示)
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ||||||||
2 | ||||||||
3 |
(2)已知反应一是放热反应,画出能量关系示意图.
(3)为加快反应一的速率,可采取的措施有:适当升高温度、选用恰当的催化剂、增大某一反应物的浓度和 .
(4)方法一的化学方程式是 .
(5)用方法二也能制得B:甲和丙反应的产物与A反应即可,这两种方法更好的是(填“方法一”或“方法二”),理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为14.X是元素周期表中原子半径最小的元素,Z与X原子的最外层电子数相同,Y与W同主族.下列说法正确的是( )
A.X与Y只能形成一种化合物
B.原子半径:r(Y)<r(W)<r(Z)
C.W的简单气态氢化物的热稳定性比Y的强
D.Z的最高价氧化物对应的水化物是酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究乙烯与溴的加成反应,甲同学设计并进行如下实验:先取一定量的工业用乙烯气体(在储气瓶中),使气体通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应;乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊物质,推测在工业上制得的乙烯中还可能含有少量还原性气体杂质,由此他提出必须先除去杂质,然后乙烯再与溴水反应。
请你回答下列问题。
(1)甲同学的实验中与乙烯有关的化学方程式为:______________________。
(2)甲同学设计的实验________(填“能”或“不能”)验证乙烯与溴发生加成反应,其理由是________。(填写序号)
①使溴水褪色的反应未必是加成反应
②使溴水褪色的反应就是加成反应
③使溴水褪色的物质未必是乙烯
④使溴水褪色的物质就是乙烯
(3)乙同学推测此乙烯中必定含有一种杂质气体是________,它与溴水反应的化学方程式是_______________。在验证过程中必须全部除去。除去该杂质的试剂可用________。
(4)为验证这一反应是加成反应而不是取代反应,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用硫酸铝酸性溶液制备可溶性的碱式硫酸铝[Ala(SO4)b(OH)c],并用它对烟气进行脱硫处理的过程如图1: 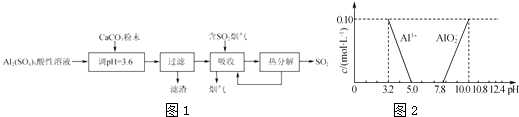
(1)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Ala(SO4)b(OH)c . 过滤时所用的玻璃仪器有、和烧杯,滤渣的主要成分为(填化学式).
(2)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将(填“增大”“减小”或“不变”).
(3)Ala(SO4)b(OH)c中a、b、c的代数关系式为 .
(4)已知在常温下溶液中Al3+、AlO2﹣的浓度与溶液pH的关系如图2所示.为确定碱式硫酸铝的组成,进行如下实验: ①取2.18g碱式硫酸铝样品在空气中灼烧至恒重,样品质量减少了0.36g.
②另取2.18g碱式硫酸铝溶于水,调节溶液的pH到5.0~7.8.
③将②产生的沉淀过滤、洗涤、灼烧至恒重,称量剩余固体为1.02g.
请计算样品中Al3+和SO42﹣的物质的量之比(写出计算过程).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com