
����Ŀ��ʵ������������������Һ�Ʊ������Եļ�ʽ������[Ala��SO4��b��OH��c]�������������������������Ĺ�����ͼ1�� 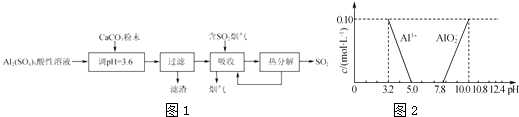
��1����CaCO3������Һ��pH��3.6����Ŀ�����к���Һ�е��ᣬ��ʹAl2��SO4��3ת��ΪAla��SO4��b��OH��c �� ����ʱ���õIJ��������������ձ�����������Ҫ�ɷ�Ϊ���ѧʽ����
��2�����������о���ȫ�ȷֽ�ų���SO2������С�����յ�SO2��������Ҫԭ������������SO2ǰ����Һ��ȣ��ȷֽ��ѭ�����õ���Һ��pH�����������С�����䡱����
��3��Ala��SO4��b��OH��c��a��b��c�Ĵ�����ϵʽΪ ��
��4����֪�ڳ�������Һ��Al3+��AlO2����Ũ������ҺpH�Ĺ�ϵ��ͼ2��ʾ��Ϊȷ����ʽ����������ɣ���������ʵ�飺 ��ȡ2.18g��ʽ��������Ʒ�ڿ��������������أ���Ʒ����������0.36g��
����ȡ2.18g��ʽ����������ˮ��������Һ��pH��5.0��7.8��
�۽��ڲ����ij������ˡ�ϴ�ӡ����������أ�����ʣ�����Ϊ1.02g��
�������Ʒ��Al3+��SO42�������ʵ���֮�ȣ�д��������̣���
���𰸡�
��1��©������������CaSO4
��2����Һ�еIJ���SO32�� ��������SO42������С
��3��3a=2b+c
��4���⣺�ɲ���ٿ�֪n��H2O��=0.36 g/18 gmol��1=0.02 mol������n��OH����=0.02 mol��2=0.04 mol��
�ɢۿ�֪1.02 gΪAl2O3����n��Al2O3��=1.02 g/102 gmol��1=0.01 mol��������Ʒ��n��Al3+��=0.02 mol ���ݵ���غ��֪����Ʒ��n��SO42����=��0.02 mol��3��0.04 mol��/2=0.01 mol������n��Al3+����n��SO42����=0.02 mol��0.01mol=2��1��
����Ʒ��Al3+��SO42�������ʵ���֮��Ϊ2��1��
���������⣺�������̿�֪��Al2��SO4��3��Һ�м���CaCO3������Һ��pH��3.6��ʹAl2��SO4��3ת��ΪCaSO4���������˵�����ΪCaSO4 �� ��Һ�к��������ӡ���������ӵȣ����պ��ж������������������Һ����������������ӣ�������������ӻᱻ�������������ᣬ����Һ�ټ����������ηֽ����ɶ�������������Һѭ������������������������1������ʱ���õIJ���������©�������������ձ���ͨ�����Ϸ���֪�������ijɷ���CaSO4 �� ���Դ��ǣ�©������������CaSO4����2����Һ���ն�����������SO32�� �� ����Һ��SO32���ױ���������SO42�� �� �������������о���ȫ�ȷֽ�ų���SO2������С�����յ�SO2������Һ��SO32��������������ӱ���������Ϊת��ΪSO42�� �� SO42��Ϊǿ������ӣ�����Һ������ǿ��pH��С��
���Դ��ǣ���Һ�еIJ���SO32�� ��������SO42������С����3�����ݻ������л��ϼ۴�����Ϊ���֪abc�Ĺ�ϵΪ3a=2b+c��
���Դ��ǣ�3a=2b+c��


 ����ѧ���ʱѧ����ϵ�д�
����ѧ���ʱѧ����ϵ�д� �ʰ�Ӣ��ͬ����ϰ��ϵ�д�
�ʰ�Ӣ��ͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������AgNO3��Cu(NO3)2�Ļ����Һ�м���Zn����Һ���������Zn��������ϵ����ͼ��ʾ������˵����ȷ����

A. ȡa����Һ������ΪZn(NO3)2��Cu(NO3)2
B. c����Һ������ΪZn(NO3)2
C. ��ȡb��c�ι��壬�μ�ϡ���ᣬ�����ݲ���
D. ȡd��Ĺ�����2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У��������( )
A. ��Ȼ�����Ȼ��Ʋ��ܵ��磬���Ȼ����ǵ����
B. ��ˮ��pH���¶ȵ����߶���С
C. �ڴ�������Һ�м��������������ƣ���Һ��c(OH��)����
D. �ڴ�ˮ�м�����������泥�������ˮ�ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҷ����Ԫ�صļ���ɾ��������ĸ�������ɣ���������ѡ�õ�ʵ����Ʒ���ܶ��õ����ǣ� �� 
A.����Ҷ���ջһ���ѡ�â١��ں͢�
B.��Ũ�����ܽ��Ҷ�Ҳ�������ˮϡ�ͣ�ѡ�âܡ��͢�
C.���˵õ�����Һ��ѡ�âܡ��ݺ͢�
D.������Һ�е�Fe3+ �� ѡ�âۡ���͢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CuSO4��һ����Ҫ�Ļ���ԭ�ϣ��й��Ʊ�;����������ͼ��ʾ������˵��������ǣ� �� 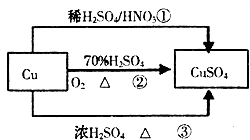
A.;�������û�����H2SO4��HNO3���ʵ���֮�����Ϊ3��2
B.�����;���١��ۣ�;���ڸ��õ���������ɫ��ѧ˼��
C.���ɵ���������ͭ������;���вμӷ�Ӧ����������ʵ�������=�ڣ���
D.����;�����Ʊ�16g����ͭ������ԭ����������ʵ���Ϊ0.1mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����л����У�ֻ�������ˮ����һһ������ǣ� ��
A.��ϩ���������Ȼ�̼
B.������Ȳ����ϩ
C.���顢����������
D.�ױ������顢��ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�����
��1��H3PO3��NaOH��Ӧֻ����NaH2PO3��Na2HPO3������,��H3PO3Ϊ____Ԫ�ᣬNa2HPO3Ϊ_____(����������������ʽ����)��
��2�����������£�������(H3PO2)�ɷ������з�Ӧ�����ڻ�ѧ������
Ag++��H3PO2+�� =��Ag+��H3PO4+��
�Իش���������
�ٸ÷�Ӧ������������_________��
���뽫��Ӧ��������ﲹ����������ƽ�����õ����ŷ��������ת�Ƶ���Ŀ_________��
������Ӧ������10.8gAg,��ת�Ƶ��ӵ���ĿԼΪ________��
��3����ͬ�¡�ͬѹ�£�ʵ����CO2��O2��������Ļ��������ܶ���H2��20������û�������ƽ��Ħ������Ϊ______������O2���������Ϊ______(����3λ��Ч����)��
��4�����³�ѹ�£���0.2mol�ơ�þ�ֱ���뵽100mL1mol/L�������У����������������Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��NaHCO3��KHCO3�Ļ������Ʒ��ij�о���ѧϰС��������������̽�����밴Ҫ���������̽�����森
��1����̽��Ŀ�ġ�ʵ��ⶨ��Ʒ��NaHCO3��KHCO3���ʵ���֮�ȣ� ��̽��˼·�����ʵ������йط�Ӧ����������������ͨ������ȷ����Ʒ��NaHCO3��KHCO3���ʵ���֮�ȣ�
��ʵ��̽����ʵ��װ����ͼ����ʾ����һ�������Ļ������Ʒ������ƿ�У�����Ͳaע��һ�������ϡ�����ַ�Ӧ��������Ͳb�ռ���������������������Ͳ�ܱڼ��Ħ������
�������ƿ��ע���ϡ��������ΪV1mL����ַ�Ӧ����Ͳb������Ķ���ΪV2mL����Ӧ�����ɵ�CO2�������ΪmL��д����ƿ�з�Ӧ�����ӷ���ʽ ��
�������������ƿ�з��л�Ͼ��ȵ�NaHCO3��KHCO3����Ʒ3.6g������ƿ�е���һ������ϡ���ᣬ���ɵ�����������ѻ���ɱ�״����������ϡ����������ϵ��ͼ����ʾ��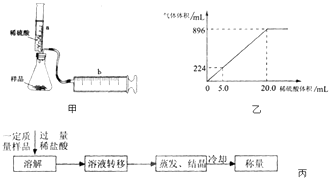
ʵ������ϡ���������ʵ����ʵ���Ũ����mol/L��
��2����Ʒ��NaHCO3��KHCO3���ʵ���֮��Ϊ �� ����չ̽����ijͬѧ�������һ�ַ����������������ͼ������ת����Һʱ�������Һת�Ʋ���ȫ�����õĻ������NaHCO3��KHCO3���ʵ���֮����ѡ�ƫ����ƫС�����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50mL NaOH��Һ����ͨ��һ������CO2��������Һ������䣩�����ȡ����Һ10mL������ϡ����100mL�������ϡ�ͺ����Һ����μ���0.1molL��1�����ᣬ����CO2������������״���£��������������������ϵ��ͼ��ʾ�� 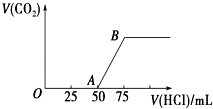
��1��д��OA����������Ӧ�����ӷ���ʽ�� ��
��2��NaOH������CO2��������Һ������Ϊ �� �����ʵ���Ũ��֮��Ϊ ��
��3��������CO2�������״���£�Ϊ ��
��4��ԭNaOH��Һ�����ʵ���Ũ��Ϊ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com