
【题目】A、B、C、D是原子序数小于20的四种元素,已知A元素+1价的阳离子与B、D的阴离子具有相同的电子层结构,B元素最高正价与负价的绝对值之差等于6.lmolC单质与足量的稀硫酸反应可生成1.5molH2 , 反应后C元素原子形成的离子和氖原子的电子层结构相同.D元素原子的最外层电子数是C元素原子的最外层电子数的2倍. 试回答:
(1)A,B,C,D四种元素依次是(写出元素名称).
(2)写出A与C、B与D最高价氧化物的水化物的化学式(按酸性或碱性由强至弱的顺序)
(3)写出A,C两元素最高价氧化物的水化物间反应的化学方程式
(4)请用电子式表示化合物A2O的形成过程: .
【答案】
(1)钾、氯、铝、硫
(2)碱性:KOH>Al(OH)3 , 酸性:HClO4>H2SO4
(3)KOH+Al(OH)3=KAlO2+2H2O
(4)![]()
【解析】解:A、B、C、D是原子序数小于20的四种元素,B元素最高正价的绝对值与负价的绝对值之差等于6,则B为第ⅦA族元素,F元素没有正化合价,所以B为氯元素;A元素+1价的阳离子与B、D的阴离子具有相同的电子层结构,即核外电子数为18,则A为K元素;lmolC单质与足量的稀硫酸反应可生成1.5molH2 , 则C为金属,根据电子转移守恒可知,C原子最外层电子数为3,可推知C为Al;D元素原子的最外层电子数是C元素原子的最外层电子数的2倍,故D原子最外层电子数为6,D离子核外电子数为18,则D为S元素.(1)由上述分析可知,A、B、C、D四种元素依次是:钾、氯、铝、硫, 所以答案是:钾、氯、铝、硫(2)A与C最高价氧化物对应水化物分别为KOH、Al(OH)3 , 金属性K>Al,故碱性:KOH>Al(OH)3 ,
B与D最高价氧化物的水化物分别为HClO4、H2SO4 , 非金属性Cl>S,故酸性:HClO4>H2SO4 ,
所以答案是:碱性:KOH>Al(OH)3 , 酸性:HClO4>H2SO4;
·(3)A与C最高价氧化物对应水化物分别为KOH、Al(OH)3 , 二者反应生成偏铝酸钾与水,反应方程式为:KOH+Al(OH)3=KAlO2+2H2O,
所以答案是:KOH+Al(OH)3=KAlO2+2H2O;(4)用电子式表示化合物K2O的形成过程: ![]() ,
,
所以答案是: ![]() .
.


科目:高中化学 来源: 题型:
【题目】草酸是基本有机合成原料,广泛用于医药、冶金和化工等部门。某校课外小组的同学拟利用乙炔合成H2C2O4·2H2O。回答下列问题:
(1)甲组的同学拟用电石(主要成分CaC2,含CaS和Ca3P2等杂质)制取C2H2[反应方程式为CaC2 +2H2O=Ca(OH)2 +C2H2(g) △H<0,该反应剧烈],实验装置如下:
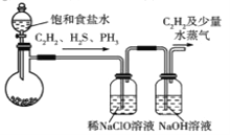
A B C
①装置A中,为减小产生乙炔的速率,除用饱和食盐水代替水外,还可采取的措施是_____(举一例)。
②装置A中,Ca3P2与水反应的化学方程式为_______________________________________;
装置B中,NaClO被还原为氯化钠,反应过程中还有极少量Cl2生成。写出H2S被NaClO溶液氧化为硫酸的主要反应的离子方程式:___________________________。
③装罝C中NaOH溶液的作用是___________________________________________________。
(2)乙组的同学拟用甲组制取的乙炔与浓硝酸在Hg(NO3)2催化下反应,并经结晶和重结晶得H2C2O4·2H2O。制备装置如下:
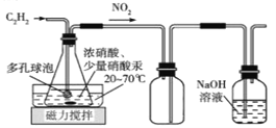
D E F
①装置D中多孔球泡的作用是___________________________________________;装置E的作用是__________________________________________________________;
②装置D生成H2C2O4 反应的化学方程式为______________________________________。
(3)丙组的同学拟设计实验证明草酸具有还原性。简单的实验方案为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是中学化学中五种常见元素,有关信息如下:
元素 | 有关信息 |
A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
B | 地壳中含量最多的元素 |
C | 单质须保存在煤油中 |
D | 单质与NaOH溶液反应可用于生产漂白液 |
E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
请回答下列问题:
(1)A的氢化物分子的电子式是 , 其最高价氧化物对应的水化物与其氢化物反应的离子方程式: .
(2)B,C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为 .
(3)A、D的氢化物相互反应,产生白色固体,对该固体中阳离子存在检验的操作方法及现象是: , 证明存在该阳离子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组晶体类型完全不一样的一组是( )
A.CaO,NO,CO
B.CCl4、H2O2、He
C.CO2、SiO2、NaCl
D.CH4、O2、Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示. 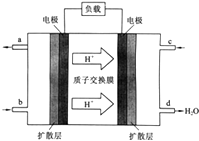
①该电池工作时,b口通入的物质为 , c口通入的物质为 .
②该电池负极的电极反应式为: .
③工作一段时间后,当12.8g甲醇完全反应生成CO2时,有NA个电子转移.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温、同压下等质量的SO2气体和CO2气体,下列有关比较的叙述中,正确的是①密度比为16:11 ②密度比为11:16 ③体积比为16:11 ④体积比为11:16( )
A.①③
B.①④
C.②③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列装置和操作不能达到实验目的的是( )
|
|
|
|
A.从含碘CCl4溶液中提取碘和回收CCl4溶剂 | B.萃取操作过程中的放气 | C.定量测定化学反应速率 | D.比较KMnO4、Cl2、S的氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示. 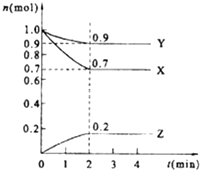
(1)由图中所给数据进行分析,该反应的化学方程式为;
(2)反应从开始至2分钟,用Z的浓度变化表示的平均反应速率为v(Z)=;
(3)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足: n (X)=n (Y)=n (Z),则原混合气体中a:b= .
(4)下列措施能加快反应速率的是(多选).
A.恒压时充入He
B.恒容时充入He
C.恒容时充入X
D.及时分离出Z
E.升高温度
F.选择高效的催化剂
(5)下列说法正确的是(单选).
A.升高温度改变化学反应的限度
B.已知正反应是吸热反应,升高温度平衡向右移动,正反应速率加快,逆反应速率减慢
C.化学反应的限度是不可能改变的
D.增大Y的浓度,正反应速率加快,逆反应速率减慢.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com