
【题目】实验室里,从废旧钴酸锂离子电池的正极材料(在铝箔上涂覆活性物质LiCoO2)中,回收钴、锂的操作流程如下图所示:
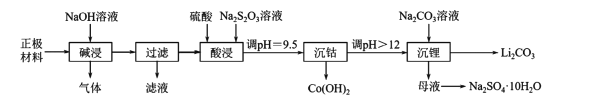
回答下列问题。
(1)拆解废旧电池获取正极材料前,先将其浸入NaCl溶液中,使电池短路而放电,此时溶液温度升高,该过程中能量的主要转化方式为____。
(2)“碱浸”过程中产生的气体是____;“过滤”所得滤液用盐酸处理可得到氢氧化铝,反应的化学方程式为____。
(3)“酸浸”时主要反应的离子方程式为____;若硫酸、Na2S2O3溶液用一定浓度的盐酸替代,也可以达到“酸浸”的目的,但会产生____(填化学式)污染环境。
(4)“沉钴”时,调pH所用的试剂是____;“沉钴”后溶液中c(Co2+)=____。(已知:Ksp[Co(OH)2]=1.09×l0-15)
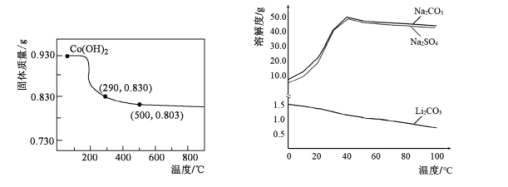
(5)在空气中加热Co(OH)2,使其转化为钴的氧化物。加热过程中,固体质量与温度的关系如左下图所示。290~500℃,发生反应的化学方程式为____。
(6)根据右下图判断,“沉锂”中获得Li2CO3固体的操作主要包括____、____、洗涤、干燥等步骤。
【答案】化学能→电能→热能 H2 NaAlO2+HCl+H2O=NaCl+Al(OH)3↓ 8LiCoO2+ S2O32-+22H+=8Li++8Co2++2SO42-+11H2O Cl2 NaOH溶液或氢氧化钠固体 1.09×l0-6mol/L 6Co2O3![]() 4Co3O4+ O2↑ 蒸发浓缩 趁热过滤
4Co3O4+ O2↑ 蒸发浓缩 趁热过滤
【解析】
正极材料主要由Al和LiCoO2组成,LiCoO2属于盐类,由复分解反应的条件可判断,其与NaOH溶液混合不发生反应,故“碱浸”过程中只有Al和NaOH反应生成偏铝酸钠和氢气,过滤得到滤渣为LiCoO2;“酸浸”时反应物有LiCoO2、硫酸和Na2S2O3溶液,依据“沉钴”产物为Co(OH)2可判断,反应后钴元素的价态从+3价降为+2价,依据氧化还原反应规律以及工艺中最后还可获得Na2SO4·10H2O副产品,可推知S元素价态升高并转化为SO42-;之后调节pH值得到Co(OH)2沉淀,再加入碳酸钠溶液调节pH值沉锂,得到碳酸锂和母液,母液结晶得到Na2SO4·10H2O。
(1)依据“电池短路而放电”“溶液温度升高”两项信息,即可判断废旧电池的处理过程中能量的主要转化方式为化学能→电能→热能;
(2)依题中信息可知,正极材料主要由Al和LiCoO2组成,LiCoO2属于盐类,由复分解反应的条件可判断,其与NaOH溶液混合不发生反应,故“碱浸”过程中只有Al和NaOH反应,生成NaAlO2和H2;“过滤”所得滤液用适量盐酸处理可以得到氢氧化铝,方程式为NaAlO2+HCl+H2O=NaCl+Al(OH)3↓;
(3)根据分析可知“酸浸”时Na2S2O3被氧化为SO42-,Co元素被还原,结合电子守恒和元素守恒可知离子反应方程式为:8LiCoO2+ S2O32-+22H+=8Li++8Co2++2SO42-+11H2O;加入的Na2S2O3 起还原作用,用一定浓度的盐酸替代“Na2S2O3溶液和硫酸”,也能实现酸浸目的,可知该反应中,盐酸也起了还原剂的作用,氧化产物为会污染环境的Cl2;
(4)结合“沉锂”后母液中还可以获得Na2SO4·10H2O,可知用的试剂为NaOH溶液或固体;溶液pH=9.5,则溶液中c(OH-)=10-4.5mol/L,带入Ksp[Co(OH)2]= c2(OH-)·c(Co2+)=1.09 ×l0-15求得c(Co2+)=1.09×l0-6mol/L;
(5)从图中信息可知,加热前的反应物为Co(OH)2 (0.930g) ,其物质的量为0.01mol,依据钴元素的量不变可知: n(Co)=0.01 mol, m(Co)=0.590g,温度升温290℃时,转化为0.830g某种钴的氧化物,该氧化物中,n(O)=![]() =0.015mol,由此可以确定该氧化物为Co2O3;同理可以确定500℃时,n(O)=
=0.015mol,由此可以确定该氧化物为Co2O3;同理可以确定500℃时,n(O)=![]() ≈0.0133mol,则生成的氧化物为Co3O4;所以290℃~500℃过程中,Co2O3转化为Co3O4,反应过程中,Co元素化合价降低。氧元素化合价升高并转化为O2,故反应的化学方程式为6Co2O3
≈0.0133mol,则生成的氧化物为Co3O4;所以290℃~500℃过程中,Co2O3转化为Co3O4,反应过程中,Co元素化合价降低。氧元素化合价升高并转化为O2,故反应的化学方程式为6Co2O3![]() 4Co3O4+ O2↑;
4Co3O4+ O2↑;
(6)分析溶解度曲线可知LiCO3微溶,其溶解度随温度升高而降低,为了提高锂元素的回收率,同时防止硫酸钠析出,应采用蒸发浓缩(减少溶剂)并在较高温度下趁热过滤等操作。


 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】常温下,二元弱酸 H2Y 溶液中滴加 KOH 溶液,所得混合溶液的 pH 与离子浓度变化的关系如下图所示,下列有关说法错误的是
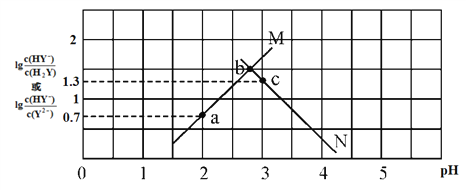
A. 曲线 M 表示 pH与 lg![]() 的变化关系
的变化关系
B. a点溶液中:c(H+) ― c(OH-)=2c(Y2-)+c(HY-) ― c(K+)
C. H2Y 的第二级电离常数Ka2(H2Y)=10-4.3
D. 交点b的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0.1mol/L的Al2(SO4)3溶液中滴加1.0mol/L的NaOH溶液,滴加过程中溶液pH随NaOH溶液体积变化的曲线如图所示.下列分析不正确的是
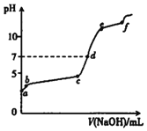
A.a点pH<7的原因:Al3++3H2OAl(OH)3+3H+
B.bc段发生的主要反应:Al3++3OH=Al(OH)3
C.ef段发生的主要反应:Al(OH)3+OH=AlO2+2H2O
D.d点,溶液中大量存在的离子是Na+、AlO2和SO42
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯(![]() )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
![]() (g)
(g)![]()
![]() (g)+H2(g) △H
(g)+H2(g) △H
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ/mol | 412 | 348 | 612 | 436 |
计算上述反应的△H=________ kJ·mol-1。
(2)500℃时,在恒容密闭容器中,充入a mol乙苯,反应达到平衡后容器内气体的压强为P;若再充入bmol的乙苯,重新达到平衡后容器内气体的压强为2P,则a_______b(填“>” “<”或“=”),乙苯的转化率将________(填“增大” “减小”或“不变”)。
(3)工业上,通常在乙苯(EB)蒸气中掺混N2(原料气中乙苯和N2的物质的量之比为1︰10,N2不参与反应),控制反应温度600℃,并保持体系总压为0.1Mpa不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
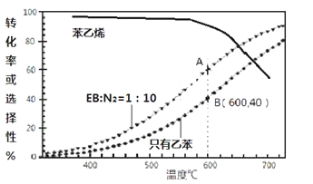
①A,B两点对应的正反应速率较大的是________。
②掺入N2能提高乙苯的平衡转化率,解释说明该事实___________________________。
③用平衡分压代替平衡浓度计算600℃时的平衡常数Kp=________。(保留两位有效数字,分压=总压×物质的量分数)
④控制反应温度为600℃的理由是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4 是一种清洁、高效、具有优良的环保性能的燃料,其燃烧热为890.3kJ·mol-1。它可以作为燃料电池的燃料。
(1)写出甲烷燃烧的热化学方程式:____________________________________________;
(2)以甲烷、空气、氢氧化钾溶液为原料,惰性电极为电极可以构成燃料电池。该电池的负极反应式为____
(3)用(2)中的燃料电池为电源,以石墨为电极电解500mL滴有酚酞的NaCl溶液,装置如图所示:
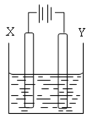
①请写出电解过程中阴极附近观察到的现象:____________________。
②当燃料电池消耗2.8L O2(标准状况下)时,计算此时NaCl溶液的pH=__________ (假设溶液的体积不变,气体全部从溶液中逸出)。在Y极通过的电子的物质的量为:_______________________。
③电解之后,要使溶液恢复原状,应该向溶液中加入物质 _________(填名称)。溶液中Cl―流向 ____________极(填“X”或“Y”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2催化加氢制甲醇,是极具前景的温室气体资源化研究领域。在某CO催化加氢制甲醇的反应体系中,发生的主要反应有:
i.CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.4kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.4kJ·mol-1
ⅱ.CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2=+41.2kJ·mol-1
CO(g)+H2O(g) △H2=+41.2kJ·mol-1
ⅲ.CO(g)+2H2(g) ![]() CH3OH(g) △H3
CH3OH(g) △H3
(1)△H3________ kJ·mol-1
(2)5MPa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
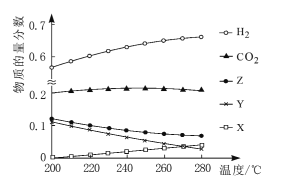
①体系中CO2的物质的量分数受温度的影响不大,原因是____。
②250℃时,反应ii的平衡常数____1(填“>”“<”或“=”)。
③下列措施中,无法提高甲醇产率的是____(填标号)。
A 加入适量CO B 增大压强 C 循环利用原料气 D 升高温度
④如图中X、Y分别代表____(填化学式)。
(3)反应i可能的反应历程如下图所示。
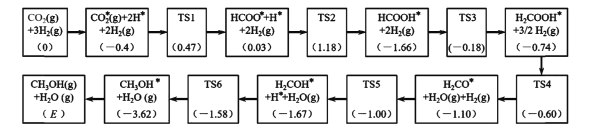
注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字或字母,单位:eV)。其中,TS表示过渡态、*表示吸附在催化剂上的微粒。
①反应历程中,生成甲醇的决速步骤的反应方程式为____。
②相对总能量E=____(计算结果保留2位小数)。(已知:leV=1.6×10-22kJ)
(4)用电解法也可实现CO2加氢制甲醇(稀硫酸作电解质溶液)。电解时,往电解池的____极通入氢气,阴极上的电极反应为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能用勒夏特列原理解释的是( )
A.H2、I2(g)混合气体加压后颜色变深B.过量空气有利于SO2转化为SO3
C.向氯水中加石灰石可提高次氯酸的浓度D.光照新制氯水,氯水颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kpa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为__________________。
(2)C(石墨)与适量H2O(g)反应生成标准状况下CO和H2各2.24L时,吸收13.13kJ热量,该反应的热化学方程式为__________________。
(3)已知HCN稀溶液与NaOH稀溶液反应生成1mol H2O时,放出12.1热量,用离子方程式表示该反应的热化学方程为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中的溶解氧(DO)的多少是衡量水体水质的重要指标。某化学小组测定某河流中氧的含量,经查阅有关资料了解到溶解氧测定可用“碘量法”,
Ⅰ.用已准确称量的硫代硫酸钠(Na2S2O3)固体配制一定体积的cmol/L标准溶液;
Ⅱ.用水样瓶取河流中水样v1mL并立即依次序注入1.0mLMnCl2溶液和1.0mL碱性KI溶液,塞紧瓶塞(瓶内不准有气泡),反复震荡后静置约1小时;
Ⅲ.向水样瓶中加入1.0mL硫酸溶液,塞紧瓶塞,振荡水样瓶至沉淀全部溶解,此时溶液变为黄色; Ⅳ.将水样瓶内溶液全量倒入锥形瓶中,用硫代硫酸钠标准溶液滴定;
V.待试液呈淡黄色后,加1mL淀粉溶液,继续滴定到终点并记录消耗的硫代硫酸钠溶液体积为v2。
已知:I2 +2Na2S2O3 =2NaI+Na2S4O6
(1)在滴定环节中使用的仪器有滴定管夹、铁架台、烧杯、锥形瓶和________________________。
(2)在步骤Ⅱ中,水样中出现了MnMnO3沉淀,离子方程式为4Mn2++O2+8OH-![]() 2MnMnO3↓+4H2O。
2MnMnO3↓+4H2O。
(3)步骤Ⅲ中发生反应的离子方程式为 _______________________________________________________________。
(4)滴定时,溶液由__________色到______________色,且半分钟内颜色不再变化即达到滴定终点。
(5)河水中的溶解氧为_____________________________mg/L。
(6)当河水中含有较多NO3-时,测定结果会比实际值________(填偏高、偏低或不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com