
【题目】依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kpa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为__________________。
(2)C(石墨)与适量H2O(g)反应生成标准状况下CO和H2各2.24L时,吸收13.13kJ热量,该反应的热化学方程式为__________________。
(3)已知HCN稀溶液与NaOH稀溶液反应生成1mol H2O时,放出12.1热量,用离子方程式表示该反应的热化学方程为_______________。
【答案】CH3OH(l) + ![]() O2(g) = CO2(g)+2H2O(l) △H= 725.76kJmol1 C(s)+H2O(g) = CO(g) + H2(g) △H= + 131.3kJmol1 HCN(aq) + OH-(aq)=CN-(aq)+H2O(l) △H= 12.1kJmol1
O2(g) = CO2(g)+2H2O(l) △H= 725.76kJmol1 C(s)+H2O(g) = CO(g) + H2(g) △H= + 131.3kJmol1 HCN(aq) + OH-(aq)=CN-(aq)+H2O(l) △H= 12.1kJmol1
【解析】
⑴在25℃、101kpa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇32g燃烧生成CO2和液态水时放热22.68kJ×32 = 725.76kJ。
⑵C(石墨)与适量H2O(g)反应生成标准状况下CO和H2各2.24L即0.1mol时,吸收13.13kJ热量,则生成气体各1mol吸收131.3 kJ热量。
⑶已知HCN稀溶液与NaOH稀溶液反应生成1mol H2O时,放出12.1热量,HCN是弱酸,因此在书写离子方程式时写化学式。
⑴在25℃、101kpa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇32g燃烧生成CO2和液态水时放热22.68kJ×32 = 725.76kJ,因此甲醇燃烧热的热化学方程式为CH3OH(l) + ![]() O2(g)=CO2(g)+2H2O(l) △H= 725.76kJmol1;故答案为:CH3OH(l) +
O2(g)=CO2(g)+2H2O(l) △H= 725.76kJmol1;故答案为:CH3OH(l) + ![]() O2(g)=CO2(g)+2H2O(l) △H= 725.76kJmol1。
O2(g)=CO2(g)+2H2O(l) △H= 725.76kJmol1。
⑵C(石墨)与适量H2O(g)反应生成标准状况下CO和H2各2.24L即0.1mol时,吸收13.13kJ热量,则生成气体各1mol吸收131.3 kJ热量,因此该反应的热化学方程式为C(s)+H2O(g) = CO(g) + H2(g) △H= + 131.3kJmol1;C(s)+H2O(g) = CO(g) + H2(g) △H= + 131.3kJmol1。
⑶已知HCN稀溶液与NaOH稀溶液反应生成1mol H2O时,放出12.1热量,HCN是弱酸,因此在书写离子方程式时写化学式,其离子方程式表示该反应的热化学方程为HCN(aq) + OH-(aq)=CN-(aq)+H2O(l) △H= 12.1kJmol1;故答案为:HCN(aq) + OH-(aq)=CN-(aq)+H2O(l) △H= 12.1kJmol1。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某同学称取9.00g淀粉溶于水,测定淀粉的水解百分率.其程序如下:
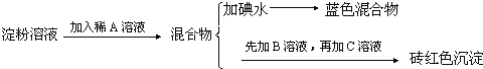
试回答下列问题:
(1)各步加入的试剂为:A_________,B_________,C_________;
(2)加入A溶液而不加入B溶液是否可以_________,其理由是_________;
(3)写出淀粉水解的方程式_________;
(4)当析出1.44g砖红色沉淀时,淀粉水解率是_________;[已知葡萄糖与Cu(OH)2反应的化学方程式为:CH2OH(CHOH)4CHO+2Cu(OH)2![]() CH2OH(CHOH)4COOH+Cu2O↓+2H2O]。
CH2OH(CHOH)4COOH+Cu2O↓+2H2O]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里,从废旧钴酸锂离子电池的正极材料(在铝箔上涂覆活性物质LiCoO2)中,回收钴、锂的操作流程如下图所示:
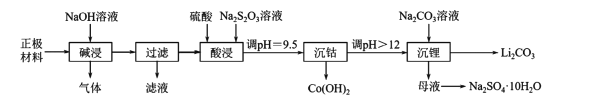
回答下列问题。
(1)拆解废旧电池获取正极材料前,先将其浸入NaCl溶液中,使电池短路而放电,此时溶液温度升高,该过程中能量的主要转化方式为____。
(2)“碱浸”过程中产生的气体是____;“过滤”所得滤液用盐酸处理可得到氢氧化铝,反应的化学方程式为____。
(3)“酸浸”时主要反应的离子方程式为____;若硫酸、Na2S2O3溶液用一定浓度的盐酸替代,也可以达到“酸浸”的目的,但会产生____(填化学式)污染环境。
(4)“沉钴”时,调pH所用的试剂是____;“沉钴”后溶液中c(Co2+)=____。(已知:Ksp[Co(OH)2]=1.09×l0-15)
(5)在空气中加热Co(OH)2,使其转化为钴的氧化物。加热过程中,固体质量与温度的关系如左下图所示。290~500℃,发生反应的化学方程式为____。
(6)根据右下图判断,“沉锂”中获得Li2CO3固体的操作主要包括____、____、洗涤、干燥等步骤。
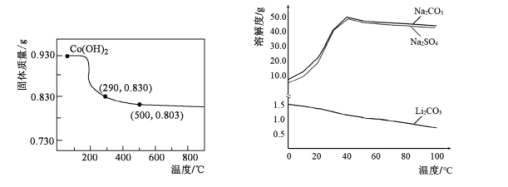
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中通入一定量的A、B,发生反应A、B,发生反应:A(g)+2B(g)![]() 3C(g)+D(l),下图是A的正反应速率v(A)随时间变化的示意图。下列说法正确的是( )
3C(g)+D(l),下图是A的正反应速率v(A)随时间变化的示意图。下列说法正确的是( )
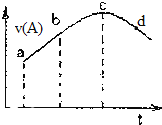
A.反应物A的浓度:a点小于b点
B.可能是某种物质对反应起到的催化作用
C.曲线上的c、d两点都表示达到反应限度
D.平均反应速率:ab段大于bc段
查看答案和解析>>
科目:高中化学 来源: 题型:
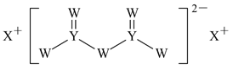
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列说法错误的是
A.气态氢化物的稳定性:Z>Y
B.W和Y形成的晶体为共价晶体
C.Y单质的熔点低于X单质
D.化合物M中W、Y都满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性条件下,黄铁矿(FeS2)催化氧化的反应方程式为2FeS2 + 7O2+ 2H2O = 2Fe2+ + 4SO42 + 4H+。实现该反应的物质间转化如图所示。下列分析正确的是

A.反应Ⅰ中Fe(NO)2+作氧化剂
B.在酸性条件下,黄铁矿催化氧化中NO作中间产物
C.由反应Ⅱ可知,氧化性:Fe3+>SO42
D.反应Ⅲ的离子方程式为Fe2+ + NO =Fe(NO)2+,该反应是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不正确的是( )
A. 表示反应4CO(g)+2NO2(g)N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
表示反应4CO(g)+2NO2(g)N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
B. b表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数小于CH3COOH的电离平衡常数
b表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数小于CH3COOH的电离平衡常数
C. c是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1 > p2
c是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1 > p2
D. d是在平衡体系的溶液中溶入少量KCl固体后化学反应速率随时间变化的图象
d是在平衡体系的溶液中溶入少量KCl固体后化学反应速率随时间变化的图象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,用0.1mol/L盐酸滴定20mL0.1mol/L氨水的图像如图所示,下列说法正确的是
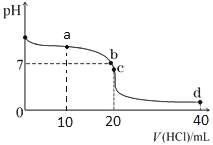
A.a点时2c(Cl-)=c(NH3H2O)+c(NH4+)
B.b点表示酸碱恰好完全反应
C.c点时c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.a、b、c、d均有c(NH4+)+c(H+)=c(Cl-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是原子序数依次增大的前四周期元素。
是原子序数依次增大的前四周期元素。![]() 是宇宙中最丰富的元素;
是宇宙中最丰富的元素;![]() 元素原子基态时,核外电子均排布在3个能级上,且它们的价电子层上均有两个未成对电子;向含
元素原子基态时,核外电子均排布在3个能级上,且它们的价电子层上均有两个未成对电子;向含![]() 的溶液中滴加氨水,形成蓝色沉淀,再滴加氨水,沉淀溶解,得到深蓝色溶液。回答下列问题:
的溶液中滴加氨水,形成蓝色沉淀,再滴加氨水,沉淀溶解,得到深蓝色溶液。回答下列问题:
(1)第一电离能![]() ____
____![]() ,电负性
,电负性![]() ____
____![]() (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)
(2)写出与![]() 分子互为等电子体的一种离子的化学式_________。
分子互为等电子体的一种离子的化学式_________。
(3)若向含有![]() 的硫酸盐溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有____________色晶体析出,该晶体中,中心离子的电子排布式为____________,配体为____________。
的硫酸盐溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有____________色晶体析出,该晶体中,中心离子的电子排布式为____________,配体为____________。
(4)已知![]() 形成的一组二元化合物化学式:
形成的一组二元化合物化学式:![]() 、
、![]() 、
、![]() 、
、![]() 其中,
其中,![]() 分子中
分子中![]() 原子的杂化类型为___________;这组化合物的通式为________________。
原子的杂化类型为___________;这组化合物的通式为________________。
(5)已知![]() 和
和![]() 可以形成
可以形成![]() 和
和![]() 两种化合物,试根据有关信息完成下列问题:
两种化合物,试根据有关信息完成下列问题:
①用球棍模型表示的![]() 分子结构是_______________。
分子结构是_______________。
A.![]() B.
B.![]() C.
C.![]() D.
D.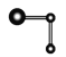
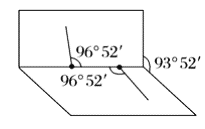
②已知![]() 子的结构如图所示:
子的结构如图所示:![]() 分子不是直线形的,两个
分子不是直线形的,两个![]() 原子犹如在半展开的书的两面上,两个
原子犹如在半展开的书的两面上,两个![]() 原子在书脊位置上,书页夹角为
原子在书脊位置上,书页夹角为![]() ,而
,而![]() 键与
键与![]() 键的夹角均为
键的夹角均为![]() 。则
。则![]() 子的电子式为_________,结构式为_________,
子的电子式为_________,结构式为_________,![]() 分子是_______(填“极性”或“非极性”)分子。
分子是_______(填“极性”或“非极性”)分子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com