
【题目】在恒温恒容的密闭容器中通入一定量的A、B,发生反应A、B,发生反应:A(g)+2B(g)![]() 3C(g)+D(l),下图是A的正反应速率v(A)随时间变化的示意图。下列说法正确的是( )
3C(g)+D(l),下图是A的正反应速率v(A)随时间变化的示意图。下列说法正确的是( )
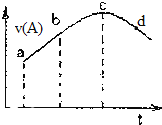
A.反应物A的浓度:a点小于b点
B.可能是某种物质对反应起到的催化作用
C.曲线上的c、d两点都表示达到反应限度
D.平均反应速率:ab段大于bc段
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】
芳香族化合物A(![]() )是重要的有机化工原料。由A制备有机化合物F的合成路线(部分反应条件略去)如图所示:
)是重要的有机化工原料。由A制备有机化合物F的合成路线(部分反应条件略去)如图所示:
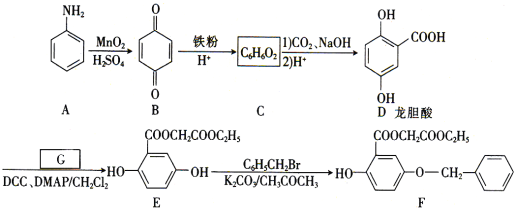
(1)A的分子式是______,B中含有的官能团的名称是_________。
(2)D→E的反应类型是_______。
(3)已知G能与金属钠反应,则G的结构简式为_________。
(4)写出E→F的化学方程式:_________。
(5)写出符合下列条件的龙胆酸乙酯(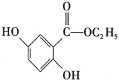 )的同分异构体有______种,写出其中一种同分异构体的结构简式:_________________ 。
)的同分异构体有______种,写出其中一种同分异构体的结构简式:_________________ 。
①能发生银镜反应,与FeCl3溶液不发生显色反应,但水解产物之一能与FeCl3溶液发生显色反应;②核磁共振氢谱有四组峰,且峰的面积之比为6:2:1:1。
(6)已知: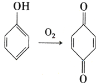 。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(
。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(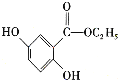 )的合成路线(无机试剂任用):________。
)的合成路线(无机试剂任用):________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯(![]() )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
![]() (g)
(g)![]()
![]() (g)+H2(g) △H
(g)+H2(g) △H
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ/mol | 412 | 348 | 612 | 436 |
计算上述反应的△H=________ kJ·mol-1。
(2)500℃时,在恒容密闭容器中,充入a mol乙苯,反应达到平衡后容器内气体的压强为P;若再充入bmol的乙苯,重新达到平衡后容器内气体的压强为2P,则a_______b(填“>” “<”或“=”),乙苯的转化率将________(填“增大” “减小”或“不变”)。
(3)工业上,通常在乙苯(EB)蒸气中掺混N2(原料气中乙苯和N2的物质的量之比为1︰10,N2不参与反应),控制反应温度600℃,并保持体系总压为0.1Mpa不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
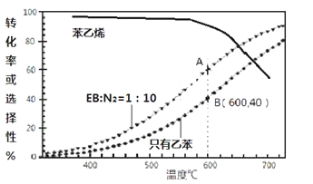
①A,B两点对应的正反应速率较大的是________。
②掺入N2能提高乙苯的平衡转化率,解释说明该事实___________________________。
③用平衡分压代替平衡浓度计算600℃时的平衡常数Kp=________。(保留两位有效数字,分压=总压×物质的量分数)
④控制反应温度为600℃的理由是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2催化加氢制甲醇,是极具前景的温室气体资源化研究领域。在某CO催化加氢制甲醇的反应体系中,发生的主要反应有:
i.CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.4kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.4kJ·mol-1
ⅱ.CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2=+41.2kJ·mol-1
CO(g)+H2O(g) △H2=+41.2kJ·mol-1
ⅲ.CO(g)+2H2(g) ![]() CH3OH(g) △H3
CH3OH(g) △H3
(1)△H3________ kJ·mol-1
(2)5MPa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
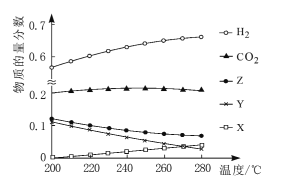
①体系中CO2的物质的量分数受温度的影响不大,原因是____。
②250℃时,反应ii的平衡常数____1(填“>”“<”或“=”)。
③下列措施中,无法提高甲醇产率的是____(填标号)。
A 加入适量CO B 增大压强 C 循环利用原料气 D 升高温度
④如图中X、Y分别代表____(填化学式)。
(3)反应i可能的反应历程如下图所示。
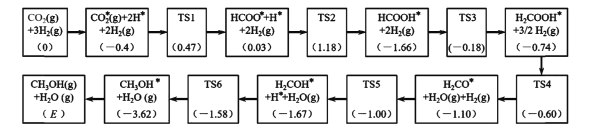
注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字或字母,单位:eV)。其中,TS表示过渡态、*表示吸附在催化剂上的微粒。
①反应历程中,生成甲醇的决速步骤的反应方程式为____。
②相对总能量E=____(计算结果保留2位小数)。(已知:leV=1.6×10-22kJ)
(4)用电解法也可实现CO2加氢制甲醇(稀硫酸作电解质溶液)。电解时,往电解池的____极通入氢气,阴极上的电极反应为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能用勒夏特列原理解释的是( )
A.H2、I2(g)混合气体加压后颜色变深B.过量空气有利于SO2转化为SO3
C.向氯水中加石灰石可提高次氯酸的浓度D.光照新制氯水,氯水颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个绝热恒容的密闭绝热容器中进行下列两个可逆反应:
甲:C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
乙:CO(g)+H2O(g) ![]() CO2(g)+H2(g)现有下列状态:
CO2(g)+H2(g)现有下列状态:
①混合气体平均相对分子质量不再改变;②气体的总物质的量不再改变;③各气体浓度相等;④反应体系中温度保持不变;⑤断裂氢氧键速率是断裂氢氢键速率的2倍;⑥混合气体密度不变;⑦v(H2O):v(H2)=1:1;⑧容器内压强不变。其中能表明甲、乙容器中反应都达到平衡状态的是( )
A.①③④⑥B.④⑤⑥⑦
C.④⑤⑧D.②④⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kpa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为__________________。
(2)C(石墨)与适量H2O(g)反应生成标准状况下CO和H2各2.24L时,吸收13.13kJ热量,该反应的热化学方程式为__________________。
(3)已知HCN稀溶液与NaOH稀溶液反应生成1mol H2O时,放出12.1热量,用离子方程式表示该反应的热化学方程为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
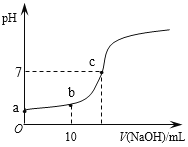
A. a点的pH=1
B. b点时,c (CH3COO—)=0.05mol/L
C. c点时,V(NaOH)=20mL
D. 反应过程中![]() 的值不断增大
的值不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下对核外电子运动状况的描述正确的是( )
A.当碳原子的核外电子排布由![]() 转变为
转变为![]() 时,这一过程中释放能量
时,这一过程中释放能量
B.电子在钠原子的核外空间运动状态有11个
C.同一原子中,![]() ,
,![]() ,
,![]() 能级的轨道依次增多
能级的轨道依次增多
D.在同一能级上运动的电子,其运动状态可能相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com