
【题目】下列图示与对应的叙述不正确的是( )
A. 表示反应4CO(g)+2NO2(g)N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
表示反应4CO(g)+2NO2(g)N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
B. b表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数小于CH3COOH的电离平衡常数
b表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数小于CH3COOH的电离平衡常数
C. c是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1 > p2
c是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1 > p2
D. d是在平衡体系的溶液中溶入少量KCl固体后化学反应速率随时间变化的图象
d是在平衡体系的溶液中溶入少量KCl固体后化学反应速率随时间变化的图象
科目:高中化学 来源: 题型:
【题目】向0.1mol/L的Al2(SO4)3溶液中滴加1.0mol/L的NaOH溶液,滴加过程中溶液pH随NaOH溶液体积变化的曲线如图所示.下列分析不正确的是
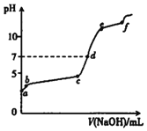
A.a点pH<7的原因:Al3++3H2OAl(OH)3+3H+
B.bc段发生的主要反应:Al3++3OH=Al(OH)3
C.ef段发生的主要反应:Al(OH)3+OH=AlO2+2H2O
D.d点,溶液中大量存在的离子是Na+、AlO2和SO42
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能用勒夏特列原理解释的是( )
A.H2、I2(g)混合气体加压后颜色变深B.过量空气有利于SO2转化为SO3
C.向氯水中加石灰石可提高次氯酸的浓度D.光照新制氯水,氯水颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kpa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为__________________。
(2)C(石墨)与适量H2O(g)反应生成标准状况下CO和H2各2.24L时,吸收13.13kJ热量,该反应的热化学方程式为__________________。
(3)已知HCN稀溶液与NaOH稀溶液反应生成1mol H2O时,放出12.1热量,用离子方程式表示该反应的热化学方程为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水:C1-+2H2O![]() H2↑+Cl2↑+OH-
H2↑+Cl2↑+OH-
B.铅蓄电池充电时阳极反应式为:PbSO4–2e-+2H2O=PbO2+4H++SO42―
C.氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e-=4OH-
D.钢铁发生电化学腐蚀的正极反应式:Fe–2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
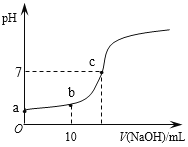
A. a点的pH=1
B. b点时,c (CH3COO—)=0.05mol/L
C. c点时,V(NaOH)=20mL
D. 反应过程中![]() 的值不断增大
的值不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是
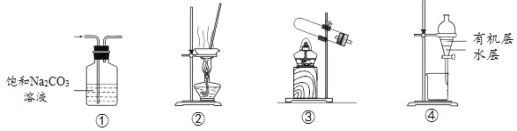
A.用①装置除去CO2中含有的少量SO2
B.用②装置蒸干饱和AlCl3溶液制备AlCl3晶体
C.用③装置加热NH4Cl固体制取NH3
D.用④装置分离乙酸乙酯与水的混合液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中的溶解氧(DO)的多少是衡量水体水质的重要指标。某化学小组测定某河流中氧的含量,经查阅有关资料了解到溶解氧测定可用“碘量法”,
Ⅰ.用已准确称量的硫代硫酸钠(Na2S2O3)固体配制一定体积的cmol/L标准溶液;
Ⅱ.用水样瓶取河流中水样v1mL并立即依次序注入1.0mLMnCl2溶液和1.0mL碱性KI溶液,塞紧瓶塞(瓶内不准有气泡),反复震荡后静置约1小时;
Ⅲ.向水样瓶中加入1.0mL硫酸溶液,塞紧瓶塞,振荡水样瓶至沉淀全部溶解,此时溶液变为黄色; Ⅳ.将水样瓶内溶液全量倒入锥形瓶中,用硫代硫酸钠标准溶液滴定;
V.待试液呈淡黄色后,加1mL淀粉溶液,继续滴定到终点并记录消耗的硫代硫酸钠溶液体积为v2。
已知:I2 +2Na2S2O3 =2NaI+Na2S4O6
(1)在滴定环节中使用的仪器有滴定管夹、铁架台、烧杯、锥形瓶和________________________。
(2)在步骤Ⅱ中,水样中出现了MnMnO3沉淀,离子方程式为4Mn2++O2+8OH-![]() 2MnMnO3↓+4H2O。
2MnMnO3↓+4H2O。
(3)步骤Ⅲ中发生反应的离子方程式为 _______________________________________________________________。
(4)滴定时,溶液由__________色到______________色,且半分钟内颜色不再变化即达到滴定终点。
(5)河水中的溶解氧为_____________________________mg/L。
(6)当河水中含有较多NO3-时,测定结果会比实际值________(填偏高、偏低或不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,下列关于实验现象的描述正确的是( )
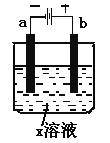
a电极 | b电极 | x溶液 | 实验现象 | |
A | 石墨 | 石墨 | CuCl2 | a电极质量增加,b电极放出无色气体 |
B | Fe | 石墨 | KNO3 | a电极质量增加,b电极放出无色气体 |
C | Fe | Cu | CuSO4 | a电极质量增加,b电极质量减少 |
D | 石墨 | 石墨 | HCl | A电极放出无色气体,b电极放出无色气体 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com