
在由水电离产生的H+浓度为1×10-13mol/L的溶液中,一定能大量共存的离子组是
① K+、Cl-、NO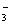 、S2- ②K+、Fe2+、I-、SO
、S2- ②K+、Fe2+、I-、SO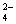 ③ Na+、Cl-、NO
③ Na+、Cl-、NO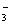 、SO
、SO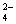
④Na+、Ca2+、Cl-、HCO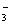 ⑤ K+、Ba2+、Cl-、NO
⑤ K+、Ba2+、Cl-、NO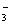
A.①③ B.③⑤ C.③④ D.②⑤
 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程。
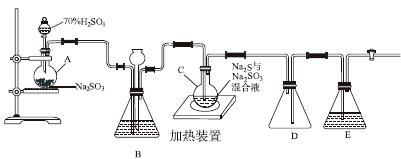
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)===3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)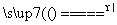 Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若________________,则整个装置气密性良好。装置D的作用是__________。装置E中为________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择________。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是__________________________。已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是__________________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有________。
a.烧杯 b.蒸发皿
c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论:________________________________________。
已知Na2S2O3·5H2O遇酸易分解:S2O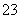 +2H+===S↓+SO2↑+H2O
+2H+===S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,反应后固体物质增重的是
A.氢气通过灼热的Cu0粉末
B.二氧化碳通过Na202粉末
C.铝与Fe203发生铝热反应
D.将锌粒投入Cu(N03)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如图所示。请回答下列问题

(1)碘是_________(填颜色)固体物质,实验室常用_________方法来分离提纯含有少量杂质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。电解时,阳极上发生反应的电极反应式为______________________;阴极上观察到的实验现象是____________________。
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验电解液中是否有
I-的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。
①实验方法 。
②实验现象及结论: 。
(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下
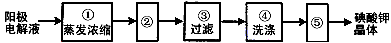
步骤②的操作名称是________________,步骤⑤的操作名称是___________。步骤④洗涤晶体的目的是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下在一容积不变的密闭容器中发生可逆反应2X(g)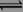 Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是
A.2v正(X)=v逆(Y) B.单位时间内生成1 mol Y的同时生成2 mol X
C.混合气体的密度不再变化 D.反应容器中Y的质量分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知:①Fe(s)+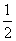 O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
②2Al(s)+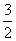 O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是 。
某同学认为,铝热反应可用于工业炼铁,你的判断是 (填“能”或“不能”),
你的理由是 。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,
如图所示。
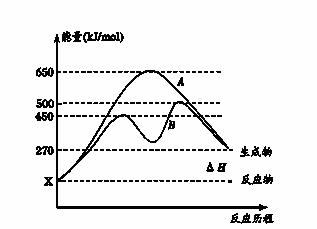
①据图判断该反应是___(填“吸”或“放”)热反应,当反应达到平衡后,其他
条件不变,升高温度,逆反应速率将____(填“增大”、“减小”或“不变”)。
②其中B历程表明此反应采用的条件为________(填字母)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)已知热化学方程式:H2(g)+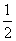 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
胶体区别于其它分散系的本质特征是( )。
A.胶体的分散质能透过滤纸
B.胶体能产生丁达尔现象
C.胶体分散质粒子直径在1~100nm之间
D.胶体是纯净物,其它分散系是混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
由CO2、H2组成的混合气在同温、同压下与氮气的密度相同。则该混合气体中CO2、H2气体的体积比为( )。
A.29∶8 B.22∶1 C.13∶8 D.8∶13
查看答案和解析>>
科目:高中化学 来源: 题型:
H2O2在工业、农业、医药上都有广泛的用途。
(1)许多物质都可以做H2O2分解的催化剂。一种观点认为:在反应过程中催化剂先被H2O2氧化(或还原),后又被H2O2还原(或氧化)。下列物质都可做H2O2分解的催化剂,在反应过程中先被氧化,后被还原的是 。
a、 I- b、 Fe3+ c、 Cu2+ d、 Fe2+
(2)用碱性氢氧燃料电池合成H2O2,具有效率高,无污染等特点。电池总反应为:
H2 + O2 + OH-=H2O + HO2-。写出正极反应式: 。
(3)H2O2是一种环境友好的强氧化剂。电镀废水(主要含Cu2+、Ni2+,还含少量Fe3+、Fe2+、Cr3+ 等)制备硫酸镍的一种流程如下:

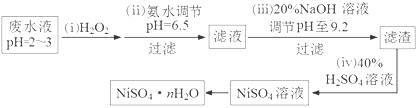
①第(ⅰ)步,加入H2O2反应的离子方程式 。
②为测定NiSO4·nH2O的组成,进行如下实验:称取 2.627g样品,配制成250.00 mL溶液。准确量取配制的溶液25.00 mL,用0.04000 mol·L-1的EDTA(Na2H2Y)标准溶液滴定Ni2+(离子方程式为Ni2++ H2Y2-=NiY2-+ 2H+),消耗EDTA标准溶液25.00 mL。则硫酸镍晶体的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com