
【题目】铁、钴(Co)、镍(Ni)是同族元素,都是较活泼的金属,它们的化合物在工业上有重要的应用。
(1)Fe2(SO4)3和明矾一样也具有净水作用,其净水的原理是__________________(用离子方程式表示)。
(2)已知某溶液中,Co2+、Ni2+的浓度分别为0.6 mol/L和1.2 mol/L ,取一定量的该溶液,向其中滴加NaOH溶液,当Co(OH)2开始沉淀时,溶液中![]() 的值等于_____。
的值等于_____。
(已知Ksp[Co(OH)2]=6.0×10-15,Ksp[Ni(OH)2]=2.0×10-15)
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。
已知高铁酸盐热稳定性差,工业上用湿法制备K2FeO4的流程如下图所示:

①上述氧化过程中,发生反应的离子方程式是: _________________________,
在实际生产中一般控制反应温度30℃以下,其原因是:
________________________________________________________。
②反应③加入浓KOH溶液可析出高铁酸钾(K2FeO4),这说明________________。
③某温度下,将Cl2通入NaOH溶液中,反应后得到NaCl、NaClO、NaClO3的混合溶液, 经测定ClO-与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为______________。
(4)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如下图所示:阳极的电极反应式为___________________;其中可循环使用的物质____________。

【答案】 Fe3++3H2O![]() Fe(OH)3(胶体)+3H+ 3 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O 防止生成的高铁酸钠发生分解 该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小 11:3 Fe+8OH--6e-=FeO42-+4H2O NaOH溶液
Fe(OH)3(胶体)+3H+ 3 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O 防止生成的高铁酸钠发生分解 该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小 11:3 Fe+8OH--6e-=FeO42-+4H2O NaOH溶液
【解析】(1)三价铁离子水解产生氢氧化铁胶体,离子方程式为:Fe3++3H2OFe(OH)3(胶体)+3H+,胶体表面积大,吸附能力强,达到净水目的;
(2)Ksp[Co(OH)2]=6.0×10-15,Ksp[Ni(OH)2]=2.0×10-15,对于同种类型的沉淀,Ksp越小,越难溶,
则在滴加氢氧化钠溶液的过程中,二价镍离子先沉淀,Ni2++2OH-=Ni(OH)2↓,当Co2+开始沉淀时,溶液中存在两个溶解平衡:CO(OH)2CO2++2OH-,Ni(OH)2Ni2++2OH-,根据Ksp[Co(OH)2]计算出此时溶液中c(OH-),c(OH-)=![]() ==10-7mol/L,则溶液中剩下的镍离子浓度c(Ni2+)=
==10-7mol/L,则溶液中剩下的镍离子浓度c(Ni2+)=![]() ==0.2mol/L,溶液中
==0.2mol/L,溶液中![]() =
=![]() =3;
=3;
(3)①氯气与氢氧化钠反应产生强氧化剂次氯酸钠,硝酸铁水解产生氢氧化铁胶体,次氯酸钠将氢氧化铁氧化成高铁酸钠,离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;已知高铁酸盐热稳定性差,在实际生产中一般控制反应温度30℃以下,其原因是防止生成的高铁酸钠发生分解;
②加入浓KOH溶液可析出高铁酸钾(K2FeO4),说明该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小;
③Cl2生成ClO-与ClO3-是被氧化的过程,化合价分别由0价升高为+1价和+5价,经测定ClO-和ClO3-物质的量之比为1∶2,则可设ClO-为1mol,ClO3-为2mol,被氧化的氯元素的物质的量为:1mol+2mol=3mol,根据化合价变化可知,反应中失去电子的总物质的量为:1mol×(1-0)+2mol×(5-0)=11mol,氧化还原反应中得失电子数目一定相等,则该反应中失去电子的物质的量也是11mol,Cl2生成KCl是被还原的过程,化合价由0价降低为-1价,则被还原的Cl的物质的量为:![]() =11mol,所以被还原的氯元素和被氧化的氯元素的物质的量之比为11mol:3mol=11∶3;
=11mol,所以被还原的氯元素和被氧化的氯元素的物质的量之比为11mol:3mol=11∶3;
(4)阳极是铁,故阳极上铁放电生成FeO42-,由于是碱性环境,故电极方程式为:Fe+8OH--6e-=FeO42-+4H2O,在电解时,水电离的H+在阴极放电:2H++2e-=H2↑,c(OH-)增大,Na+通过阳离子交换膜进入阴极区,使阴极区c(NaOH)增大,故NaOH可以循环使用。


科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al混合物投入到200mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是

A. Mg和Al的总质量为9g
B. 最初20mLNaOH溶液用于中和过量的稀硫酸
C. NaOH溶液物质的量浓度为5mol·L-1
D. 生成的氢气在标准状况下的体积为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以CH4为原料制备H2的原理为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。在一定条件下向a、b两个恒温恒容的密闭容器中均通入1.1molCH4(g)和1.1molH2O(g),测得两容器中CO的物质的量随时间的变化曲线分别为a和b。已知容器a的体积为10L,温度为Ta,下列说法不正确的是
CO(g)+3H2(g)。在一定条件下向a、b两个恒温恒容的密闭容器中均通入1.1molCH4(g)和1.1molH2O(g),测得两容器中CO的物质的量随时间的变化曲线分别为a和b。已知容器a的体积为10L,温度为Ta,下列说法不正确的是
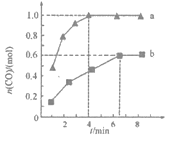
A. 容器a中CH4从反应开始到怡好平衡时的平均反应速率为0.025mol·L-1·min-1
B. a、b两容器的温度可能相同
C. 在达到平衡前,容器a的压强逐渐增大
D. 该反应在Ta温度下的平衡常数为27(mol·L-1)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修3:物质结构与性质]固体电解质有广泛的用途。研究发现,晶体中有特殊结构为离子(如Li+)提供快速迁移的通道或者有“点缺陷”。都能使其具有导电潜力,比如:图(a)所示的锂超离子导体Li3SBF4和图(b)所示的有“点缺陷”的NaCl。
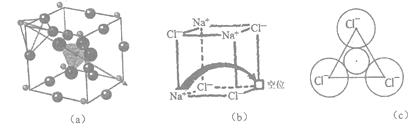
根据所学知识回答下列问题:
(1)在变化“Cl+e-→Cl-”过程中,所得电子填充在基态 Cl的________能级,此过程会________ (填“吸收”或“释放”)能量。
(2)BF4-中B的杂化形式为________________,其等电子体为___________(任写一种)。与其VSEPR模型相同,且有l对孤电子对的相对分子质量最小的分子是___________。
(3)图(a)所示晶胞中Li+位于_____位置;若将晶体中BF4-换成F-,导电能力会明显降低,原因是______________________________。
(4)图(6)中,若缺陷处填充了Na+,则它__________(填“是”或“不是”) NaCl的晶胞,在NaCl晶体中,Na+填充在Cl-堆积而成的__________面体空隙中。
(5)有人认为:高温下有“点缺陷”的NaCl晶伙导电性增照是由于Na+迁移到另一空位而造成。其中Na+经过一个由3个Cl-组成的最小三角形窗孔(如图c所示)。已知晶胞参数a=564 pm,r(Na+)=116pm, r(Cl-)=167 pm,通过计算三角形窗孔半径,判断该认识是否正确。__________。(已知:![]() ≈1.414,
≈1.414,![]() ≈1.732)
≈1.732)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙叉环丙烷(b)由于其特殊的电子结构,一直受到结构和理论化学家的注意。根据其转化关系,判断下列说法正确的是

A. b的一氯取代物只有2种
B. b易发生加成、氧化、缩聚反应
C. p的所有原子都在一个平面内
D. m的属于芳香族化合物的同分异构体有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应 | 大气固氮 | 工业固氮 | |||
温度/℃ | 27 | 2000 | 25[ | 400 | 450 |
K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于__________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因__________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是______(填“A”或“B”);比较р1、р2的大小关系_______。

(3)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)![]() 4NH3(g)+3O2(g),则其反应热ΔH=___________________。
4NH3(g)+3O2(g),则其反应热ΔH=___________________。
(已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1
2H2(g) +O2(g)![]() 2H2O(l) △H=-571.6kJ·mol-1 )
2H2O(l) △H=-571.6kJ·mol-1 )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中能用来区别SO2和CO2气体的是( ) ①石灰水
②H2S溶液
③酸性KMnO4
④氯水
⑤品红溶液
⑥紫色石蕊试液.
A.①②③⑤
B.①⑥
C.①
D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属性质的叙述正确的是( )
A.金属单质在化学反应中往往表现出还原性
B.因为铁和铝一样可以在空气中形成致密的氧化膜,所以铁制品不需要额外保护措施
C.自然界中的金属均以化合态形式存在
D.金属是导热性和导电性优良的固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com