
【题目】短周期元素W、X、Y、Z的原子序数依次增大。n、p、q是由这些元素组成的二元化合物,m是元素Y的单质,p是一种淡黄色粉末,q的水溶液可在玻璃器皿上蚀刻标记,0.01mol/Ls溶液的pH为12。上述物质的转化关系如图所示。下列说法正确的是
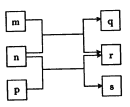
A. 离子半径:X>Y>Z
B. 氧化性:r>m
C. p和q中均含有离子键
D. 等体积等浓度的q溶液与s溶液反应后,溶液呈中性
【答案】A
【解析】试题分析:短周期元素组成的二元化合物p是一种淡黄色粉末,则p为Na2O2;0.01mol/Ls溶液的pH为12,则s为强碱,短周期中为强碱的只有NaOH,由此可得n+p→r+s为Na2O2与H2O反应生成NaOH和O2,q的水溶液可在玻璃器皿上蚀刻标记,则q为HF;则四种原子序数依次增大的短周期元素W、X、Y、Z分别为H、O、F、Na。m是元素Y的单质,所以m是F2,r为O2。A.电子层结构相同的离子,核电荷数越大,半径越小,所以离子半径:O2->F->Na+,故A正确;B.根据反应2F2+2H2O=4HF+O2可得氧化性:F2>O2,故B错误;C.p为Na2O2,含有离子键和共价键,q为HF,只有共价键,故C错误;D.等体积等浓度的HF溶液与NaOH溶液反应恰好生成NaF,因为水解溶液呈碱性,故D错误;故选A。


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:

苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按以下合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白雾产生,是因为生成了_________气体,继续滴加至液溴滴完。装置d的作用是_________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是_________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是_________;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为_________,要进一步提纯,下列操作中必须的是____________(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是_____________(填入正确选项前的字母):
A.25mL B.50mL C.250mL D.500mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。请回答下列问题:
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。请回答下列问题:

(1)E的大小对该反应的反应热________影响?(填“有或无”)。该反应通常用V2O5作催化剂,加V2O5会使图中B点______(填“升高或降低”);
(2)图中ΔH=__________kJ/mol;
(3)如果反应速率υ(SO2)为0.05 mol/(L·min),则υ(O2)=___________mol/(L·min);
(4)1 mol SO2(g)氧化为1 mol SO3(g)的反应热ΔH1___________1 mol SO2(g)氧化为1 mol SO3(l)的反应热ΔH2。(填“>、<或=”)
(5)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,实验测得m(H)∶m(O)>1∶8。下列对导致这一结果的原因的分析中,一定错误的是

A. Ⅰ、Ⅱ装置之间缺少干燥装置
B. Ⅲ装置后缺少干燥装置
C. Ⅱ 装置中玻璃管内有水冷凝
D. CuO没有全部被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯氧化锌广泛应用于电子工业,某研究小组设计如下流程制备高纯氧化锌。

(1)反应①的化学方程式为___________________。
(2)反应②的基本反应类型是_____________。
(3)副产品X的化学式为:______________。从含X的滤液中获取固体X的实验操作步骤是:___________、____________、过滤。
(4)反应③属于分解反应,除得到氧化锌外还生成2种常见气体,其化学式为_________、________。
(5)若用纯度为97.5%的1kg粗锌制备高纯氧化锌,理论上最多可生产出氧化锌的物质的量为:_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物体内构成血红蛋白、叶绿素、甲状腺激素、动物骨骼的重要元素依次是
A. I、Mg、Ca、Fe B. Fe、Mg、I、Ca
C. Fe、Ca、I、Mg D. Mg、Fe、I、Ca
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是
A.2 mol水的摩尔质量和1 mol水的摩尔质量
B.200 mL 1 mol/L氯化钙溶液中c(Cl-)和100 mL 2 mol/L氯化钾溶液中c(Cl-)
C.64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D.20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关组成生物体的化学元素和化合物的叙述,正确的是( )
A. 肌肉细胞种含量最多的化合物是蛋白质
B. 人、动物与植物所含的化学元素含量和种类差异很大
C. 蛋白质,核酸等物质形成过程中都要脱去水分子
D. 人类具有一些自然界找不到的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.6g铁粉放入100mLCuSO4溶液中,充分反应后,再向溶液中加入足量的稀硫酸,又产生1.12L(标准状况下)气体。试计算:
(1)和硫酸反应的铁的质量;
(2)置换出的铜的物质的量;
(3)若最后溶液总体积为250mL,求FeSO4的物质的量浓度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com