
【题目】下列各组中的离子,能在溶液中大量共存的是 ( )
A.K+ H+ SO42- OH-B.Na+ CO32﹣ Ca2+ NO3-
C.Na+ H+ Cl- CO32﹣D.Na+ Cl- SO42- H+
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得悬浊液中逐滴加入1.00mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。 试回答:

(1)A点的沉淀物的化学式为__________________,B点的沉淀物的化学式为_____________________。
(2)写出A点到B点发生反应的离子方程式_________________________________________________。
(3)原混合物中MgCl2的质量是__________,AlCl3的质量是______________,NaOH的质量是____________。
(4)C点HCl溶液加入量为________________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点Kw的数值比c点Kw的数值大
D.b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废铁屑表面常有铁锈(成分为Fe2O3),并沾有油污。某校研究性学习小组设计实验方案,按以下①~④步骤用废铁屑制备绿矾(FeSO4·7H2O)晶体。
废铁屑 ![]() 铁屑
铁屑![]() 溶液(留有少量铁屑)
溶液(留有少量铁屑)![]() 滤液
滤液 ![]() 绿矾晶体
绿矾晶体
根据该实验方案,回答下列问题:
(1)步骤①中废铁屑与NaOH溶液共热的目的是。
(2)步骤②中烧杯底部留有少量铁屑的理由是。
说明剩余铁屑作用的离子方程式为。
(3)在步骤③中,该小组采用如图抽气过滤(减压过滤)装置代替普通漏斗,其目的是;。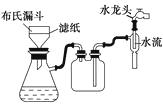
(4)检查步骤③的滤液中没有Fe3+的方法是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.通常情况下,甲烷跟强酸、强碱、强氧化剂都不反应
B.甲烷化学性质比较稳定,不能被任何氧化剂氧化
C.甲烷跟氯气反应无论生成CH3Cl、CH2Cl2、CHCl3还是CCl4 , 都属于取代反应
D.甲烷的四种取代物都难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)、硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]是重要的化学化工试剂。工业上常利用机械加工行业产生的废铁屑为原料制备。
请回答下列问题:
(1)下图所示装置用于制备绿矾。其中锥形瓶中盛放的药品或原料是 , 集气瓶的作用是;烧杯中主要发生:①CuSO4+H2S=CuS↓+H2SO4 , ②4CuSO4+PH3+4H2O=H3PO4+4H2SO4+4Cu,则烧杯中盛放的试剂是 , 其作用是。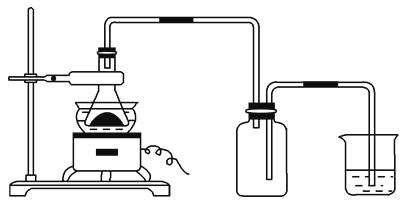
(2)下图所示装置用于制备硫酸亚铁铵。在0~60 ℃的温度范围内,硫酸亚铁铵在水中的溶解度比硫酸铵、硫酸亚铁的溶解度小,冷却混合液至室温便析出硫酸亚铁铵。具体操作:①打开活塞 , 关闭活塞 , 从分液漏斗滴入6 mol·L-1H2SO4到250 mL锥形瓶,充分反应。②待锥形瓶中的铁屑快反应完时,关闭活塞 , 打开活塞。③放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵。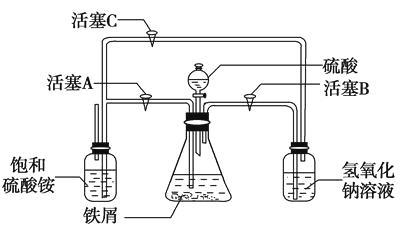
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化。设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤相同,制得硫酸亚铁铵,并对产品质量进行检测。检测结果如下:
序号 | 反应物用量 | 产品质量 |
1 | n(H2SO4)∶n(Fe)>1∶1 | 介于Ⅰ级~Ⅱ级之间 |
2 | n(H2SO4)∶n(Fe)<1∶1 | 优于Ⅰ级 |
已知产品质量标准:Fe3+的质量分数等于0.005%,产品质量定为Ⅰ级;Fe3+的质量分数等于0.01%,产品质量定为Ⅱ级,从实验结果中,可得出制备硫酸亚铁溶液时,反应控制过量为最佳。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于XOH型化合物而言,X是除H、O以外的其他元素时,下列说法中正确的是( )
A.XOH的水溶液不能导电B.当X是金属性很强的元素时,XOH一定是强碱
C.XOH一定是离子化合物D.XOH一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( ) 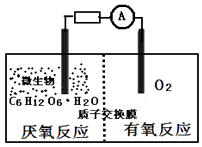
A.负极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从正极区移向负极区
D.电池总反应为C6H12O6+6O2═6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。请回答下列问题。
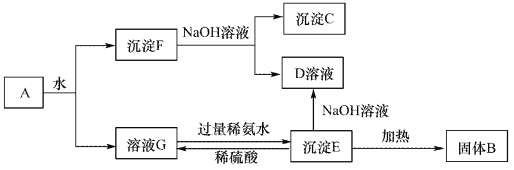
(1)沉淀F与NaOH溶液反应的离了方程式为_______________。
(2)沉淀C与稀硫酸反应的离子方程式为_______________。
(3)溶液G与过量稀氨水反应的化学方程式为_______________。
【答案】 Al2O3 + 2 OH-=AlO2-+H2O Fe2O3 + 6H+ =2 Fe3++3H2O Al2(SO4)3 + 6NH3·H2O = 2Al(OH)3↓ + 3(NH4)2SO4
【解析】根据流程可知:A溶于水得沉淀和溶液,溶液G是硫酸铝溶液,沉淀F是氧化铝和氧化铁;
将沉淀F溶于过量NaOH溶液中,Al2O3能和氢氧化钠反应,Fe2O3和氢氧化钠不反应,所以沉淀C是Fe2O3,溶液D是NaAlO2;溶液G中加入过量的氨水得到沉淀E,则E为Al(OH)3,Al(OH)3与NaOH溶液反应得到NaAlO2,将Al(OH)3加热得到沉淀B,B是Al2O3,硫酸铝和氨水反应生成Al(OH)3和硫酸铵,(1)沉淀F与NaOH溶液反应的离子方程式为:Al2O3 + 2 OH-=AlO2-+H2O;(2)沉淀C为Fe2O3,Fe2O3与稀硫酸反应的离子方程式为:Fe2O3 + 6H+ =2 Fe3++3H2O;(3)溶液G与过量稀氨水反应的化学方程式为:Al2(SO4)3 + 6NH3·H2O = 2Al(OH)3↓ + 3(NH4)2SO4。
点睛:本题考查了常见物质的分离与提纯方法综合应用,完成此类题目,可以依据题干提供的信息,结合框图,找准解题的突破口,直接得出物质,然后顺推或逆推或由两边向中间推得出其他物质,A溶于水得沉淀F和溶液G,硫酸铝易溶于水,氧化铝、氧化铁不易溶于水,所以得到的溶液G为硫酸铝溶液,沉淀F为氧化铝和氧化铁;将沉淀F溶于过量氢氧化钠溶液中,氧化铝能与氢氧化钠反应,氧化铁与氢氧化钠不反应,所以沉淀C是Fe2O3,溶液D是NaAlO2溶液,溶液G中加入过量的氨水得到沉淀E为Al(OH)3,Al(OH)3与NaOH溶液反应得到NaAlO2,将Al(OH)3加热得到沉淀B,B是氧化铝,硫酸铝和氨水反应生成氢氧化铝和硫酸铵,据此进行解答。
【题型】综合题
【结束】
27
【题目】图中是实验室制备SO2并验证SO2某些性质的装置图。试回答:
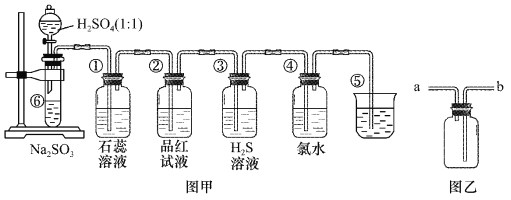
(1)如果用浓硫酸和铜来制取SO2,发生装置还需选用的仪器是________,化学方程式为_________ 。
(2)⑤的作用是________,反应的离子方程式为________ 。
(3)选用图乙收集SO2气体,气体从________ 口 进。
(4)填表格
装置 | 实验现象 | 体现SO2的性质 |
① | ____________ | ____________ |
② | ____________ | ____________ |
③ | ____________ | ____________ |
④ | ____________ | ____________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com