
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是
A.1 L 0.1 mol·L-1 AlCl3溶液中离子总数为0.4NA
B.精炼铜,若阳极重量减轻32 g,则电路中一定通过NA个电子
C.N2(g) + 3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1 若放出46.2 kJ热量,则反应消耗N2分子数为0.5NA
2NH3(g) ΔH=-92.4 kJ·mol-1 若放出46.2 kJ热量,则反应消耗N2分子数为0.5NA
D.1 mol FeCl3完全水解生成的Fe(OH)3胶粒数目小于NA
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】常温下,硫酸与 NaOH 溶液相互滴定的滴定曲线如图所示。下列有关叙述不正确的 是( )

A.曲线 a 是用 NaOH 溶液滴定硫酸的滴定曲线
B.曲线 a 和曲线 b 滴定过程中均存在:c(H+)+c(Na+)=c(OH-)+2c(SO42-)
C.用 NaOH 溶液滴定硫酸溶液时可用酚酞作指示剂
D.等体积的硫酸与 NaOH 溶液分别与等质量铝粉反 应生成 H2 的质量比一定为 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.2mol·L-1NaCN溶液中加入0.2mol·L-1的盐酸,溶液pH随所加盐酸体积的变化如图所示(M>7)。下列说法不正确的是

A. 25℃时,K(HCN)≈10-9.4
B. b点时,c(CN-)<c(HCN)
C. c点时,c(Cl-)>c(H+)+c(HCN)
D. a、b、c三点时,水的电离程度:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学式为C5H7Cl的有机物,其结构不可能是( )
A.只含1个![]() 键的直链有机物
键的直链有机物
B.含2个![]() 键的直链有机物
键的直链有机物
C.含1个![]() 键的环状有机物
键的环状有机物
D.含1个—C![]() C—键的直链有机物
C—键的直链有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,将0.10 mol·L-1 CH3COOH溶液滴加到10 mL 0.10 mol·L-1 NaOH溶液中,lg![]() 与pH的关系如图所示,C点坐标是(6,1.7)。下列说法不正确的是( )
与pH的关系如图所示,C点坐标是(6,1.7)。下列说法不正确的是( )

A. pH=7时加入的醋酸溶液的体积大于10 mL
B. C点后继续加入醋酸溶液,水的电离程度减小
C. B点存在c(Na+)-c(CH3COO-)=(10-6-10-8)mol·L-1
D. Ka(CH3COOH)=5.0×10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是一种白色剧毒晶体,是汽车安全气囊的主要成分。NaN3易溶于水,微溶于乙醇,水溶液呈弱碱性,能与酸发生反应产生具有爆炸性的有毒气体叠氮化氢。实验室可利用亚硝酸叔丁酯(t-BuNO2,以t-Bu表示叔丁基)与N2H4、氢氧化钠溶液混合反应制备叠氮化钠。
(1)制备亚硝酸叔丁酯
取一定NaNO2溶液与50%硫酸混合,发生反应H2SO4+2NaNO2===2HNO2+Na2SO4。可利用亚硝酸与叔丁醇(t-BuOH)在40 ℃左右制备亚硝酸叔丁酯,试写出该反应的化学方程式:________________。
(2)制备叠氮化钠(NaN3)
按如图所示组装仪器(加热装置略)进行反应,反应方程式为:t-BuNO2+NaOH+N2H4===NaN3+2H2O+t-BuOH。

①装置a的名称是________________;
②该反应需控制温度在65 ℃,采用的实验措施是____________________;
③反应后溶液在0 ℃下冷却至有大量晶体析出后过滤,所得晶体使用无水乙醇洗涤。试解释低温下过滤和使用无水乙醇洗涤晶体的原因是______________________________________________。
(3)产率计算
①称取2.0 g叠氮化钠试样,配成100 mL溶液,并量取10.00 mL溶液于锥形瓶中。
②用滴定管加入0.10 mol·L-1六硝酸铈铵[(NH4)2Ce(NO3)6]溶液40.00 mL[发生的反应为2(NH4)2Ce(NO3)6+2NaN3===4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](假设杂质均不参与反应)。
③充分反应后将溶液稀释并酸化,滴入2滴邻菲罗啉指示液,并用0.10 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]为标准液,滴定过量的Ce4+,终点时消耗标准溶液20.00 mL(滴定原理:Ce4++Fe2+===Ce3++Fe3+)。计算可知叠氮化钠的质量分数为__________(保留2位有效数字)。若其他操作及读数均正确,滴定到终点后,下列操作会导致所测定样品中叠氮化钠质量分数偏大的是______(填字母代号)。
A.锥形瓶使用叠氮化钠溶液润洗
B.滴加六硝酸铈铵溶液时,滴加前仰视读数,滴加后俯视读数
C.滴加硫酸亚铁铵标准溶液时,开始时尖嘴处无气泡,结束时出现气泡
D.滴定过程中,将挂在锥形瓶壁上的硫酸亚铁铵标准液滴用蒸馏水冲进瓶内
(4)叠氮化钠有毒,可以使用次氯酸钠溶液对含有叠氮化钠的溶液进行销毁,反应后溶液碱性明显增强,且产生无色无味的无毒气体,试写出反应的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知T ℃时两种弱酸的电离平衡常数如下表。将pH和体积均相同的两种酸溶液M、N分别稀释,其pH随加水体积的变化如图所示。下列叙述不正确的是
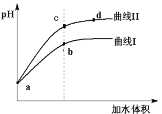
弱酸 | HNO2 | CH3COOH |
电离平衡常数 | 5.0×10-4 | 1.7×10-5 |
A.曲线Ⅰ代表CH3COOH溶液
B.M、N两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
C.溶液中水的电离程度:b点<c点
D.从c点到d点,溶液中 保持不变(其中HA、A-分别代表相应的酸和酸根离子)
保持不变(其中HA、A-分别代表相应的酸和酸根离子)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物![]() 是桥环烯烃类化合物,在药物合成、材料化学以及生命科学中有着重要的应用。下列关于该化合物的叙述正确的是( )
是桥环烯烃类化合物,在药物合成、材料化学以及生命科学中有着重要的应用。下列关于该化合物的叙述正确的是( )
A.分子式为C11H10
B.—氯代物有5种(不考虑立体异构)
C.不能形成高分子化合物
D.1mol该化合物最多能与3molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,将浓度均为0.1mol/L的HA溶液Va mL和BOH溶液Vb mL混合,保持Va+Vb=100mL,生成物BA易溶于水。Va、Vb与混合液pH的关系如下图。下列叙述错误的是

A.HA一定是弱酸
B.BOH可能是强碱
C.z点时,水的电离被促进
D.x、y、z点时,溶液中都存在c(A-)+c(OH-)=c(B+)+c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com