
【题目】已知有反应:2A(g)+B(g)![]() 3C(g) △H<0,在恒容的密闭容器中,通入A和B气体,反应达到平衡后,若仅改变图中x的值,则y随x变化趋势合理的是
3C(g) △H<0,在恒容的密闭容器中,通入A和B气体,反应达到平衡后,若仅改变图中x的值,则y随x变化趋势合理的是
选项 | x | y |
|
A | 温度 | 容器内混合气体的密度 | |
B | A的物质的量 | B的转化率 | |
C | 催化剂的质量 | C的体积分数 | |
D | 充入稀有气体 | 逆反应速率 |
A. A B. B C. C D. D
【答案】B
【解析】
反应2A(g)+B(g)![]() 3C(g) △H<0,平衡常数只随温度变化,增加B的量,促进A的转化,加入C,化学平衡逆向移动,增大压强,平衡不移动,升高温度,化学平衡逆向移动,催化剂改变反应速率,不改变化学平衡,结合图象可以知道一个量增大引起另一个量的增大来解答。
3C(g) △H<0,平衡常数只随温度变化,增加B的量,促进A的转化,加入C,化学平衡逆向移动,增大压强,平衡不移动,升高温度,化学平衡逆向移动,催化剂改变反应速率,不改变化学平衡,结合图象可以知道一个量增大引起另一个量的增大来解答。
A.达平衡后,升高温度,化学平衡逆向移动,反应前后气体体积、质量不变,密度始终不变,与图象不符合,故A错误;
B.达平衡后,增加A的物质的量,平衡正向移动,则B的转化率增大,与图象符合,所以B选项是正确的;
C.达平衡后,再加入催化剂,改变化学反应速率,化学平衡不移动,C的体积分数不变,与图象不符合,故C错误;
D.加入惰性气体,反应物和生成物的浓度都不变,所以反应速率不变,故D错误。
故选B。


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是( )

A. NaHB溶液可能为酸性,也可能为碱性
B. A、B、C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大
C. E溶液中离子浓度大小关系:c(NH4+)>c(B2-)>c(OH-)>c(H+)
D. F点溶液c(NH4+)=2c(B2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一定温度下,某容积为2 L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如右图,依图所示:
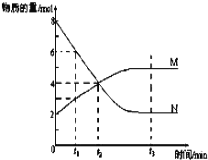
(1)该反应的化学方程式是____________________________。
(2)在图上所示的三个时刻中,_______(填t1、t2或t3)时刻达到化学反应限度。
II.一定温度下将6 mol A及6 mol B混合于2 L的密闭容器中,
发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36 mol/(L·min)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36 mol/(L·min)。求:
(1)平衡时D的浓度=___________________。
(2)B的平均反应速率υ(B)= ___________________________。
(3)x=_________。
(4)开始时容器中的压强与平衡时的压强之比为______________(化为最简整数比)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化合物是工业生产重要原料,也是大气污染的重要来源,研究氮氧化合物相关反应原理具有重要意义。回答下列问题:
(1)一步完成的反应称为基元反应,只由基元反应构成的化学反应称为简单反应,两个及以上基元反应构成的化学反应称为复杂反应,复杂反应的速率取决(等)于慢的基元反应速率。基元反应aA+bB=cC+dD的速率方程为v=k·ca(A)·cb(B),其中k为速率常数。已知反应NO2+CO=NO+CO2 ,在不同温度下反应机理不同。
①温度高于490K时,上述反应为简单反应,请写出其速率方程______________。
②温度高于520K时,该反应是由两个基元反应构成的复杂反应,其速率方程v=k·c2(NO2),已知慢的基元反应的反应物和产物为NO、NO2 、NO3,用方程式表示反应历程。
第一步:____________________(慢反应)。
第二步:____________________(快反应)。
(2)N2O4(g) ![]() 2NO2(g) ΔH =+57 kJ·mol-1 该反应是高中和大学化学学习的经典素材。
2NO2(g) ΔH =+57 kJ·mol-1 该反应是高中和大学化学学习的经典素材。
①对于上述反应下列说法不正确的一项是_________(填字母)。
A.恒温恒容,加入N2O4重新达到平衡体系颜色加深
B.恒温恒容,加入NO2重新达到平衡NO2体积分数变大
C.绝热容器中,体系颜色不变,说明该反应处于平衡状态
D. 恒温恒压下,加入N2O4重新达到平衡体系颜色不变
②T1K时,向1L真空容器中加入1molN2O4 ,达到平衡时NO2的平衡产率为20%,则该温度下的平衡常数K=____,达到平衡时吸收的热量为_____kJ。某温度下,该反应达到平衡,NO2与N2O4的混合气体总压强为100KPa,密度为同状态下氢气密度的34.5倍,平衡常数KP=____KPa(用平衡分压代替平衡浓度计算)。
③若v(N2O4)=k1·c(N2O4) v(NO2)=k2·c(NO2),T2温度下,若k1=k2 ,则T2____T1(填“高于”或“低于”)。
(3)复杂反应2NO(g)+O2(g)=2NO2(g)由两个基元反应构成,2NO(g)=N2O2(g) (快速平衡)N2O2(g) +O2(g)=2NO2(g)(慢反应),已知快反应为放热反应,其正、逆反应速率常数分别为k1和k2慢反应正、逆反应速率常数分别为k3和k4。若v正=k·c2(NO)·c(O2) 则k=______(用k1、k2、k3表示);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁触媒是重要的催化剂,铁触媒在500 ℃左右时的活性最大,这也是合成氨反应一般选择在500 ℃左右进行的重要原因之一。CO易与铁触媒作用导致其失去催化活性:Fe+5CO===Fe(CO)5;在溶液中除去CO的化学方程式为[Cu(NH3)2]OOCCH3+CO+NH3 = 刹[Cu(NH3)3(CO)]OOCCH3。请回答下列问题:
(1)基态Fe原子的核外电子排布式为[Ar]___;C、N、O的电负性由大到小的顺序为______。
(2)Cu2+在水中呈现蓝色是因为形成了四水合铜(Ⅱ)离子,其化学式为______;配合物[Cu(NH3)2]OOCCH3中,铜显___价,碳原子的杂化轨道类型是______,NH3价电子对互斥理论模型是______。
(3)用[Cu(NH3)2]OOCCH3溶液除去CO的反应中,肯定有________(填字母)形成。
A.离子键 B.配位键 C.非极性键 D.σ键
(4)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是________。
(5)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为________,面心立方堆积与体心立方堆积的两种铁晶体的密度之比为________(写出已化简的比例式即可)。(两种堆积中最邻近的铁原子的核间距相等)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关2个电化学装置的叙述正确的是

A. 装置①中,电子移动的路径是:Zn→Cu→CuSO4溶液→KCl盐桥→ZnSO4溶液
B. 在不改变总反应的前提下,装置①可用Na2SO4替换ZnSO4,用石墨替换Cu棒
C. 装置②中采用石墨电极,通电后,由于OH-向阳极迁移,导致阳极附近pH升高
D. 若装置②用于铁棒镀铜,则N极为铁棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某航空站安装了一台燃料电池,该电池可同时提供电和水蒸气,所用燃料为氢气,电解质为熔融的碳酸钾。已知电池的总反应为2H2+O2=2H2O,正极反应为![]() 。下列说法正确的是
。下列说法正确的是
A.该电池可在常温或高温时工作
B.负极反应为![]()
C.该电池工作时负极有CO2生成
D.理论上该电池供应1molH2O,同时导线中转移2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应H2(g)+I2(g)![]() 2HI(g)
2HI(g) ![]() H<0,下列说法正确的是
H<0,下列说法正确的是
A. 反应达到平衡后,缩小容器体积,混合气体平均相对分子质量变小
B. 反应达到平衡后,保持容器温度和体积不变,充入HI气体,再次达到平衡,H2转化率减小,平衡常数K值减小
C. 若v正(H2)=2v逆(HI),反应达到平衡状态
D. 反应达到平衡后,保持容器体积不变,升温,反应体系的颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是重要的化工原料,发展前景广阔。
(1)利用甲醇可制成微生物燃料电池(利用微生物将化学能直接转化成电能的装置)。某微生物燃料电池装置如下图所示:

A极附近的电极反应式是_________。
(2)研究表明CO2加氢可以合成甲醇。反应如下:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①反应的化学平衡常数表达式K=_________。
②有利于提高反应中CO2的平衡转化率的措施有_________(填序号)。
a. 使用催化剂 b. 加压 c. 增大CO2和H2的初始投料比![]()
③研究温度对于甲醇产率的影响。在210℃~290℃,保持原料气中CO2和H2的投料比不变,按一定流速通过催化剂,得到甲醇的平衡产率与温度的关系如下图所示。该反应焓变![]() H_________0(填“>”、“=”或“<”),其依据是________。
H_________0(填“>”、“=”或“<”),其依据是________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com