
【题目】已知2X2(g)+Y2(g)![]() 2Z(g)△H=-akJ·mol-1(a>0),在一个容积2L的容器中加入2mol X2和1molY2,在500℃时充分反应达平衡后Z的浓度为0.8mol·L-1,放出热量240kJ。
2Z(g)△H=-akJ·mol-1(a>0),在一个容积2L的容器中加入2mol X2和1molY2,在500℃时充分反应达平衡后Z的浓度为0.8mol·L-1,放出热量240kJ。
(1)此反应平衡常数表达式为______;若将温度降低到300℃,则反应平衡常数将_____(填增大、减少或不变)
(2)平衡时Y2的转化率为____________
(3)能说明反应己达平衡状态的是___________________________。
A.浓度c(Z)=2c(Y2) B.容器内压强保持不变
C.v(X2)=2 v(Y2) D.容器内的密度保持不变
(4)若将上述容器体积压缩到原来的一半,相同温度下起始加入2molX2和1mol Y2达到平衡后,Y2的转化率将_________________(填变大、变小或不变)
【答案】 K=![]() 增大 80% B 变大
增大 80% B 变大
【解析】(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此根据方程式可知此反应平衡常数表达式为K=![]() ;正反应是放热反应,因此若将温度降低到300℃,平衡向正反应方向进行,则反应平衡常数将增大;(2)反应达平衡后Z的浓度为0.8mol·L-1,生成Z的物质的量是0.8mol/L×2L=1.6mol,消耗Y2是0.8mol,平衡时Y2的转化率为0.8mol/1mol×100%=80%;(3)A.浓度c(Z)=2c(Y2)不能说明正逆反应速率相等,反应不一定处于平衡状态,A错误;B.正反应体积减小,容器内压强保持不变说明正逆反应速率相等,达到平衡状态,B正确;C.v(X2)=2 v(Y2)不能说明正逆反应速率相等,反应不一定处于平衡状态,C错误;D.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此容器内的密度保持不变不能说明反应达到平衡状态,D错误,答案选B。(4)若将上述容器体积压缩到原来的一半,压强增大,平衡向正反应方向进行,因此相同温度下起始加入2molX2和lmol Y2达到平衡后,Y2的转化率将变大。
;正反应是放热反应,因此若将温度降低到300℃,平衡向正反应方向进行,则反应平衡常数将增大;(2)反应达平衡后Z的浓度为0.8mol·L-1,生成Z的物质的量是0.8mol/L×2L=1.6mol,消耗Y2是0.8mol,平衡时Y2的转化率为0.8mol/1mol×100%=80%;(3)A.浓度c(Z)=2c(Y2)不能说明正逆反应速率相等,反应不一定处于平衡状态,A错误;B.正反应体积减小,容器内压强保持不变说明正逆反应速率相等,达到平衡状态,B正确;C.v(X2)=2 v(Y2)不能说明正逆反应速率相等,反应不一定处于平衡状态,C错误;D.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此容器内的密度保持不变不能说明反应达到平衡状态,D错误,答案选B。(4)若将上述容器体积压缩到原来的一半,压强增大,平衡向正反应方向进行,因此相同温度下起始加入2molX2和lmol Y2达到平衡后,Y2的转化率将变大。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式与所述事实相符且正确的是
A. Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++12HCO3-+2OH-=CaCO3 ↓+CO32-+H2O
B. 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+3H2O
C. 将饱和FeC3溶液滴入沸水中制胶体:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
D. 以铜为电极电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化物是一类重要化合物,在炸药、磁性化合物研究、微量元素测定方面越来越引起人们的重视,其中氢叠氮酸(HN3)是一种弱酸,分子结构示意图可表示为:
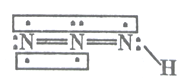
联氨被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2=2H2O+HN3,它的酸性类似于醋酸,微弱电离出H+和N3-。试回答下列问题:
(1)从成键原子的电负性角度,HN3中含有的共价键类型为_______________,分子的极性为_____________。
(2)叠氮化物能与Fe3+、Cu2+、Co3+等形成配合物,如:Co[(N3)(NH3)5]SO4,在该配合物中钴显_________价,根据价层互斥理论可知SO42-空间形状为______________,写出钴原子在基态时的核外电子排布式_____________。
(3)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是__________(选填序号)
A.NaN3与KN3结构类似,前者晶格能较小
B.钠晶胞结构如图![]() ,晶胞中分摊2个钠原子
,晶胞中分摊2个钠原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮的电负性小
(4)与N3-互为等电子体的分子有___________________ (举2例)
(5)人造立方氮化硼的硬度仅次于金刚石而远远高于其他材料,因此它与金刚石统称为超硬材料。立方氮化硼晶胞如图所示,试分析:
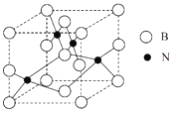
①该晶体的类别为____________晶体。
②晶体中每个N同时吸引________个B。
③设该晶体的摩尔质量为Mg·mol-1,晶体的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的B之间的距离为___________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),叙述正确的
4NO(g)+6H2O(g),叙述正确的
A. 单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达平衡状态
B. 达到化学平衡时,4v正(O2)=5v逆(NO)
C. 化学反应速率关系是:2v正(NH3)=3v正(H2O)
D. 达到平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中,发生了消去反应的是( )
A.氯苯与NaOH水溶液混合共热
B.乙醇与浓硫酸加热到170℃
C.一氯甲烷与NaOH醇溶液共热
D.CH3CH2Br和浓硫酸共热到170℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下属于新能源的主要包括( )
①核能 ②柴草 ③焦炭 ④太阳能 ⑤氢能 ⑥液化石油气 ⑦水煤气 ⑧天然气
A. ②③⑥⑦ B. ①④⑤ C. ③⑥⑦⑧ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下图装置进行实验,并回答下列问题
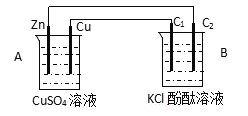
(1)判断装置的名称:A池为___________B池为____________
(2)铜极为______极,电极反应式为________________________,石墨棒C1为____极,电极反应式为___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏德罗常数,下列叙述正确的是( )
A.标准状况下,22.4LH2O含有的分子数为 NA
B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C.通常状况下,NA 个CO2分子占有的体积为22.4L
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl﹣ 个数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一充有10mL NO和NO2混合气体的试管,倒置于盛有水的水槽中,充分反应后,仍有6mL无色气体,则原混合气体中NO和NO2体积比为( )
A. 1∶4 B. 2∶3 C. 1∶3 D. 4∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com