
����Ŀ������������һ����Ҫ�������ըҩ�����Ի������о�����Ԫ�زⶨ����Խ��Խ�������ǵ����ӣ������������(HN3)��һ�����ᣬ���ӽṹʾ��ͼ�ɱ�ʾΪ��
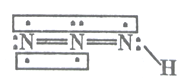
����������������ʱ��������������(HN3)��N2H4+HNO2=2H2O+HN3���������������ڴ��ᣬ�������H+��N3-���Իش��������⣺
(1)�ӳɼ�ԭ�ӵĵ縺�ԽǶ���HN3�к��еĹ��ۼ�����Ϊ_______________�����ӵļ���Ϊ_____________��
(2)������������Fe3+��Cu2+��Co3+���γ������磺Co[(N3)(NH3)5]SO4���ڸ������������_________�ۣ����ݼ۲㻥�����ۿ�֪SO42-�ռ���״Ϊ______________��д����ԭ���ڻ�̬ʱ�ĺ�������Ų�ʽ_____________��
(3)�ɵ�������(NaN3)�ȷֽ�ɵô�N2��2NaN3(s)=2Na(l)+3N2(g)���й�˵����ȷ����__________(ѡ�����)
A.NaN3��KN3�ṹ���ƣ�ǰ�߾����ܽ�С
B.�ƾ����ṹ��ͼ![]() �������з�̯2����ԭ��
�������з�̯2����ԭ��
C.���ĵ�һ�����ܴ�����
D.���������º��ȶ�������Ϊ���ĵ縺��С
(4)��N3-��Ϊ�ȵ�����ķ�����___________________ (��2����
(5)���������������Ӳ�Ƚ����ڽ��ʯ��ԶԶ�����������ϣ����������ʯͳ��Ϊ��Ӳ���ϡ�������������ͼ��ʾ���Է�����
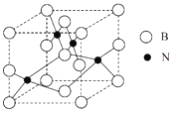
���þ�������Ϊ____________���塣
�ھ�����ÿ��Nͬʱ����________��B��
����þ����Ħ������ΪMg��mol-1��������ܶ�Ϊ��g��cm-3�������ӵ�������ֵΪNA���������������������B֮��ľ���Ϊ___________cm��
���𰸡� ���Լ����Ǽ��Լ� ���Է��� +3 �������� ls22s22p63s23p63d74s2��[Ar]3d74s2 BC N2O��CO2��CS2��BeF2�� ԭ�� 4 ![]()
��������(1) HN3�к��еĹ��ۼ���H-N���Լ���N=N�Ǽ��Լ������ݽṹ��֪���÷���ΪV�η��ӣ���ɷֲ������ȣ����ڼ��Է��ӣ��ʴ�Ϊ�����Լ����Ǽ��Լ������Է�����
(2)��������е����������Ϊ-1�ۡ����������Ϊ-2�ۣ����ݻ������и�Ԫ�ػ��ϼ۵Ĵ�����Ϊ0֪��CoԪ�ػ��ϼ�Ϊ+3�ۣ���������Ӽ۲���ӶԸ�����4�Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж���������ӿռ乹��Ϊ���������Σ�Co��27��Ԫ�أ���ԭ�Ӻ�����27�����ӣ����ݹ���ԭ����д���̬ԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p63d74s2��[Ar]3d74s2���ʴ�Ϊ��+3���������壻1s22s22p63s23p63d74s2��[Ar]3d74s2��
(3)A��NaN3��KN3�ṹ���ƣ��Ҷ��߶������Ӿ��壬�����������Ӱ뾶�ɷ��ȣ������Ӱ뾶���������ӣ�����ǰ�߾����ܴ��ں��ߣ��ʴ���B��������Naԭ�Ӹ���=8��![]() +1=2������ȷ��C��ͬһ����Ԫ�أ�Ԫ�ص�һ����������ԭ��������������������ƣ�����IIA�塢��VA���һ�����ܴ���������Ԫ�أ����Ե�һ������N��O������ȷ��D�����������к��е������������ܽϴ����ʽ��ȶ����ʴ���ѡBC��
+1=2������ȷ��C��ͬһ����Ԫ�أ�Ԫ�ص�һ����������ԭ��������������������ƣ�����IIA�塢��VA���һ�����ܴ���������Ԫ�أ����Ե�һ������N��O������ȷ��D�����������к��е������������ܽϴ����ʽ��ȶ����ʴ���ѡBC��
(4)ԭ�Ӹ�����ȼ۵�������ȵ�����Ϊ�ȵ����壬��N3-��Ϊ�ȵ�����ķ�����N2O��CO2��CS2��BeF2�ȣ��ʴ�Ϊ��N2O��CO2��CS2��BeF2�ȣ�
(5)��ԭ�Ӿ���Ӳ�ȴþ���Ӳ�ȴ�����Ϊԭ�Ӿ��壬�ʴ�Ϊ��ԭ�ӣ�
��ÿ��Nԭ��ͬʱ����4��Bԭ�ӣ���������λ����4���ʴ�Ϊ��4��
�۾������������������B֮��ľ���Ϊ�����ⳤ��![]() ���������ⳤ=
���������ⳤ=![]() ���������������������B֮��ľ���=
���������������������B֮��ľ���=![]() ��
��![]() cm=
cm=![]() ��
��![]() cm=
cm=![]() cm���ʴ�Ϊ��
cm���ʴ�Ϊ��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ�黯ѧ��ij����С��ѧ��ģ���������е�ԭ�������������볱ʪ������̼��Ӧ�����������ͼ��ʾ����������ȡ�����������������������ͼ������װ��E���ɼס���������������ɣ���������Ƥ����ͨ����װ������ˮ�����п̶ȣ�0��50mL�����������ã��ҹܿ������ƶ����Ե���Һ��ߵͣ� 
ʵ���ҿɹ�ѡ�õ�ҩƷ���У�ϡ���ᡢ���ᡢ�������ơ�̼���ơ�����ʯ��ˮ�Իش�
��1������װ�õ�����˳���ǣ�����ӿڵı�ţ��������ӽ��ܼ��г�װ�þ�ʡ�ԣ��� ��
��2��װ��C�з���ķ�Ӧ������ ��
��3��װ��A�������� �� װ��B�������� ��
��4��Ϊ�˽�ȷ�ز�����������������˱���������װ�õ�������֮�⣬�ڶ�ȡ��Ӧǰ�����Һ��Ķ����������ֵ�Ĺ����У�Ӧע��������д��ĸ��ţ���
a�������밼Һ���������ƽb���ȴ�Ƭ�̣����ҹ���Һ�治������ʱ�����̶���
c������ʱӦ�����ƶ��ҹܣ�ʹ�ס�������Һ����ƽd������ʱ��һ��ʹ�ס��ҹ�Һ����ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ж��Ʒ�Ƶ��ֻ������������ը�¹ʣ����ڶԵ�ذ�ȫ�Ե����ӳ̶�Խ��Խ�ߣ�ȼ�ϵ����Ϊ��ȫ���ܽϺõ�һ�ѧ��Դ�õ��˸���ķ�չ�� һ��������(N2H4)Ϊȼ�ϵĻ�����ع���ԭ����ͼ��ʾ������ʱ�����ȶ�����Ⱦ�����ʡ�����˵������ȷ���ǣ� ��

A. M�����ɵ����ҵ缫����pH����
B. ������ÿ����1molN2H4������4molH+ͨ�����ӽ���Ĥ
C. �����ĵ缫��ӦʽΪ��O2+4H++4e-=2H2O
D. d��������Һ��������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ȷ���ʽ��д��ȷ���ǣ� ��
A.2SO2+O2=2SO3��H=��196.6 kJ/mol
B.2H2��g��+O2��g��=2H2O��l����H=��517.6 kJ/mol
C.H2��g��+ ![]() O2��g��=H2O��l����H=��285.8 kJ
O2��g��=H2O��l����H=��285.8 kJ
D.C��s��+O2��g��=CO2��g����H=+393.5 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��A��B��C��D��E��F��ԭ�����������������ǵ�ԭ�Ӻ�����Ӳ���֮��Ϊ13��B�Ļ���������࣬��Ŀ�Ӵ�C��D�ǿ����к�����������Ԫ�أ�D��E����Ԫ�صĵ��ʷ�Ӧ�����������ֲ�ͬ�����ӻ����FΪͬ����ԭ�Ӱ뾶��С��Ԫ�أ��Իش��������⣺
��1��д��D��E��1��2��ԭ�Ӹ������γɵĻ�����ĵ���ʽ�� �� F��ԭ�ӽṹʾ��ͼΪ ��
��2��B��D�γɵĻ�����BD2�д��ڵĻ�ѧ��Ϊ��������ӡ����ۡ�����ͬ����A��C��F����Ԫ���γɵĻ�����CA4FΪ�����
��3��������ס�����A��B��D��E�е����ֻ�������ɣ��Ҽס��ҵ�ˮ��Һ���ʼ��ԣ���ס��ҷ�Ӧ�����ӷ���ʽΪ ��
��4��Ԫ��B��F�ķǽ�����ǿ����B�ķǽ�������F���ǿ���������������û�ѧ����ʽ֤���������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������[(NH4)2SO4��FeSO4��6H2O]�׳�Ī���Σ�������ˮ����100����110��ʱ�ֽ⡣�ڶ��������г������궨�ظ���ء�������ص���Һ�ı����ʣ�������ұ�𡢵�Ƶȡ�
��.��ѧ����С���о�Ī���ξ���ǿ��ʱ�ķֽ������
(1)����ͬѧ������ͼ��ʾ��װ�ý����о���װ��C�пɹ۲쵽��������___________���ɴ˿�֪�ֽ��������_____________��

(2)����ͬѧ��ΪĪ���ξ���ֽ�IJ����л�����SO3(g)��SO2(g)��N2��Ϊ������֤��ѡ�ü���ʵ���е�װ��A����ͼ��ʾ�IJ���װ�ý���ʵ����

������ͬѧ��ʵ���У�װ���������ӵĺ���˳��ΪA��__________________��
��װ��D�����������������____________������SO3��ʵ��������_______________��
��.Ϊ����������林��ȣ���ȡm gĪ������Ʒ�����500mL��Һ���ס��ҡ�����λͬѧ�������������ʵ�鷽������ش�
������ȡ25.00mL�����������Һ��0.1000mol��L-1������KMnO4��Һ�����ν��еζ���
�ҷ�����ȡ25.00mL�����������Һ��������ʵ����

����������ͨ��NH4+�ⶨ��ʵ�����ͼ����ͼ��ʾ��ȡ25.00mL�����������Һ���и�ʵ����

(3)�����е����ӷ���ʽΪ______________________����ʵ���������ȷ������ⶨ�������С���ҷ���������ԭ��Ϊ________________����֤�Ʋ�ķ���Ϊ___________________________________ ��
(4)�ҷ����г����Ƿ�ϴ�Ӹɾ��ļ��鷽����______________________________��
(5)��������������������Լ���__________________
a.ˮ b.����NaHCO3��Һ c.CCl4
(6)�����NH3�����������Ϊ��״���£�ΪV L������������林���Ϊ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��д���Fe2+��H+��SO42-����Һ�У������ܴ��������������
A. SCN��B. NO3��C. HCO3��D. Ba2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2X2(g)+Y2(g)![]() 2Z(g)��H=-akJ��mol-1(a>0)����һ���ݻ�2L�������м���2mol X2��1molY2����500��ʱ��ַ�Ӧ��ƽ���Z��Ũ��Ϊ0.8mol��L-1���ų�����240kJ��
2Z(g)��H=-akJ��mol-1(a>0)����һ���ݻ�2L�������м���2mol X2��1molY2����500��ʱ��ַ�Ӧ��ƽ���Z��Ũ��Ϊ0.8mol��L-1���ų�����240kJ��
��1���˷�Ӧƽ�ⳣ������ʽΪ______�������¶Ƚ��͵�300�棬��Ӧƽ�ⳣ����_____���������ٻ䣩
��2��ƽ��ʱY2��ת����Ϊ____________
��3����˵����Ӧ����ƽ��״̬����___________________________��
A��Ũ��c(Z)=2c(Y2) B��������ѹǿ���ֲ���
C��v��X2��=2 v(Y2) D�������ڵ��ܶȱ��ֲ���
��4�����������������ѹ����ԭ����һ�룬��ͬ�¶�����ʼ����2molX2��1mol Y2�ﵽƽ���Y2��ת���ʽ�_________________(����С��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������и�����Ϻ͵������Һ�����ԭ��ص���
ѡ�� | A | B | C | D |
�������� | Mg��Mg | Zn��Fe | ���ʯ��Cu | Zn��Cu |
�������Һ | ϡH2SO4 | �Ҵ� | Ũ H2SO4 | ϡ���� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com