
【题目】下列热方程式书写正确的是( )
A.2SO2+O2=2SO3△H=﹣196.6 kJ/mol
B.2H2(g)+O2(g)=2H2O(l)△H=﹣517.6 kJ/mol
C.H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.8 kJ
O2(g)=H2O(l)△H=﹣285.8 kJ
D.C(s)+O2(g)=CO2(g)△H=+393.5 kJ/mol
【答案】B
【解析】解:A.热化学方程式中反应焓变和物质聚集状态有关,需要标注物质聚集状态,选项中物质聚集状态未标注,故A错误;
B.热化学方程式标注物质聚集状态和对应反应的焓变写出,氢气燃烧生成水的反应为放热反应,焓变为负值,热化学方程式2H2(g)+O2(g)=2H2O(l)△H=﹣517.6 kJ/mol,故B正确;
C.热化学方程式的焓变单位为KJ/mol,热化学方程式为:H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.8 kJ/mol,故C错误;
O2(g)=H2O(l)△H=﹣285.8 kJ/mol,故C错误;
D.碳和氧气的反应是放热反应,焓变为负值,热化学方程式为:C(s)+O2(g)=CO2(g)△H=﹣393.5 kJ/mol,故D错误;
故选B.
A.热化学方程式中反应焓变和物质聚集状态有关,需要标注物质聚集状态;
B.热化学方程式标注物质聚集状态和对应反应的焓变写出;
C.热化学方程式的焓变单位为KJ/mol;
D.碳和氧气的反应是放热反应,焓变为负值.


科目:高中化学 来源: 题型:
【题目】对于ⅣA族元素,下列叙述中不正确的是( )
A. CO2在常温下是气体,SiO2在常温下是固体
B. C、Si、Ge的最外层电子数都是4,次外层电子数都是8
C. CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应
D. 该族元素的主要化合价是+4和+2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式与所述事实相符且正确的是
A. Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++12HCO3-+2OH-=CaCO3 ↓+CO32-+H2O
B. 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+3H2O
C. 将饱和FeC3溶液滴入沸水中制胶体:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
D. 以铜为电极电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
若某反应的平衡常数表达式为:K= ,请写出此反应的热化学方程式________。
,请写出此反应的热化学方程式________。
(2)用CH4催化还原NOx可以消除污染,若将反应CH4+2NO2=CO2+2H2O+N2设计为原电池,电池内部是掺杂氧化钇的氧化锆晶体,可以传导O2-,则该电池的正极反应式为________。
(3)利用H2和CO2在一定条件下可以合成乙烯:6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g)。已知不同温度对CO2的转化率及催化剂的效率影响如右图所示,下列有关说法不正确的是________(填序号)。
CH2=CH2(g)+4H2O(g)。已知不同温度对CO2的转化率及催化剂的效率影响如右图所示,下列有关说法不正确的是________(填序号)。

①不同条件下反应,N点的速率最大
②M点时平衡常数比N点时平衡常数大
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(4)在密闭容器中充入5 mol CO和4 mol NO,发生上述(1)中某反应,下图为平衡时NO的体积分数与温度、压强的关系。

回答下列问题:
①温度:T1________T2(填“<”或“>”)。
②某温度下,若反应进行到10分钟达到平衡状态D点时,容器的体积为2 L,则此时的平衡常数K=________(结果精确到两位小数);用CO的浓度变化表示的平均反应速率v(CO)=________。
③若在D点对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中的________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.加热才能发生的反应一定是吸热反应
B.化学反应的热效应的大小与参加反应的物质的多少无关
C.反应物的总能量大于生成物的总能量的反应一定是放热反应
D.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空
(1)发射卫星可用气态肼为燃料,肼的分子式为N2H4 , 肼的电子式为 .
(2)“西气东输”中的“气”指天然气,其主要成分的结构式是 . 一定量的该气体反应过程的能量变化如图所示,该反应为(填“放热”或“吸热”)反应.25℃,101kPa时,1mol该气体在氧气中燃烧放出热量为akJ,该气体燃烧的热化学方程式为 . 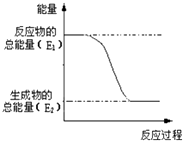
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化物是一类重要化合物,在炸药、磁性化合物研究、微量元素测定方面越来越引起人们的重视,其中氢叠氮酸(HN3)是一种弱酸,分子结构示意图可表示为:
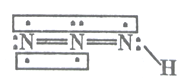
联氨被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2=2H2O+HN3,它的酸性类似于醋酸,微弱电离出H+和N3-。试回答下列问题:
(1)从成键原子的电负性角度,HN3中含有的共价键类型为_______________,分子的极性为_____________。
(2)叠氮化物能与Fe3+、Cu2+、Co3+等形成配合物,如:Co[(N3)(NH3)5]SO4,在该配合物中钴显_________价,根据价层互斥理论可知SO42-空间形状为______________,写出钴原子在基态时的核外电子排布式_____________。
(3)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是__________(选填序号)
A.NaN3与KN3结构类似,前者晶格能较小
B.钠晶胞结构如图![]() ,晶胞中分摊2个钠原子
,晶胞中分摊2个钠原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮的电负性小
(4)与N3-互为等电子体的分子有___________________ (举2例)
(5)人造立方氮化硼的硬度仅次于金刚石而远远高于其他材料,因此它与金刚石统称为超硬材料。立方氮化硼晶胞如图所示,试分析:
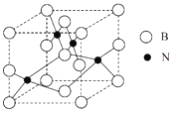
①该晶体的类别为____________晶体。
②晶体中每个N同时吸引________个B。
③设该晶体的摩尔质量为Mg·mol-1,晶体的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的B之间的距离为___________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),叙述正确的
4NO(g)+6H2O(g),叙述正确的
A. 单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达平衡状态
B. 达到化学平衡时,4v正(O2)=5v逆(NO)
C. 化学反应速率关系是:2v正(NH3)=3v正(H2O)
D. 达到平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏德罗常数,下列叙述正确的是( )
A.标准状况下,22.4LH2O含有的分子数为 NA
B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C.通常状况下,NA 个CO2分子占有的体积为22.4L
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl﹣ 个数为 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com