
【题目】某同学用如图所示的电化学装置电解硫酸铜溶液,有一个电极为Al,其它三个电极均为Cu,则下列说法正确的是( )

A.电子方向:电极Ⅳ→→电极ⅠB.电极Ⅰ发生还原反应
C.电极Ⅱ逐渐溶解D.电极Ⅲ的电极反应:Cu-2e-═Cu2+
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】下列有关平衡常数的说法中,正确的是( )
A.在任何条件下,化学平衡常数都是一个定值
B.反应 ![]() ,增大压强该反应平衡常数增大
,增大压强该反应平衡常数增大
C.对于给定可逆反应,温度一定时,其正、逆反应的平衡常数互为倒数
D.改变条件,若反应物的转化率增大,平衡常数也一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浸透了石蜡油的石棉放在试管中进行下列实验,请回答下列问题。
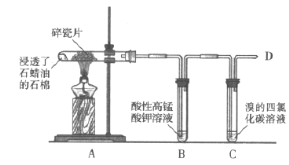
(1)反应一段时间后,B试管中的现象是___,由此说明石蜡油分解产生的气体具有___性(填“氧化”或“还原”)。
(2)若石蜡油分解产生乙烯,则C中发生反应的化学方程式是___。
(3)在D处点燃气体,观察到的现象是___。
(4)除去甲烷中混有的乙烯应采用的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向0.1molL-1NaA溶液中逐滴滴加盐酸,测得混合溶液的pH与p![]() 变化关系如图所示[p
变化关系如图所示[p![]() =-lg
=-lg![]() ]。下列说法正确的是( )
]。下列说法正确的是( )
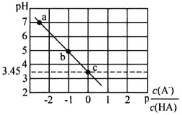
A.a点溶液中c(Na+)=c(A-)
B.电离常数K(HA)的数量级为10-4
C.滴加过程中![]() 不断减小
不断减小
D.b点溶液中c(HA)>c(Na+)>c(A-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.1molL-1HA溶液中逐滴加入0.1molL-1NaOH溶液,混合溶液的pH随滴入NaOH溶液体积的变化如图所示。下列说法错误的是( )
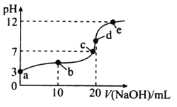
A.溶液导电性:e>d>c>b>a
B.水的电离程度:c>d>e>b>a
C.A-的水解常数:Kh≈10-9
D.b点溶液中存在![]() c(HA)=
c(HA)=![]() c(A-)+c(OH-)-c(H+)
c(A-)+c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种重要的化工产品,将SO2通入Na2CO3和Na2S混合溶液中可制得Na2S2O3。其制备装置如图所示。

(1)A中反应的化学方程式为_____。
(2)为保证Na2S和Na2CO3得到充分利用,两者的物质的量之比应为____。
(3)为了保证硫代硫酸钠的产量,实验中通人的SO2不能过量,原因是___。
(4)待Na2S和Na2CO3完全消耗后,结束反应。过滤B中的混合物,滤液经过__、___(填操作名称)、过滤、洗涤、干燥,得到Na2S2O35H2O晶体。
(5)称取10.0g产品(Na2S2O35H2O,相对分子质量为248),配成250mL溶液,取25.00mL溶液,以淀粉作指示剂,用 0.1000 mol/L碘的标准溶液滴定。(反应原理为:2S2O32-+I2 = S4O62-+2I-,忽略Na2SO3与I2反应)。
①滴定终点的现象为____。
②重复三次的实验数据如表所示,其中第三次读数时滴定管中起始和终点的液面位置如图所示,则x=____,产品的纯度为__。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

(1)气体A中的大气污染物可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在_____(填离子符号),检验溶液中还存在Fe2+的方法是________________(注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为_________________。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_________。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.阴极增加的质量一定与阳极减少的质量相同
e. 利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知重铬酸钾(K2Cr2O7)具有强氧化性,其还原产物Cr3+在水溶液中呈绿色或蓝绿色。在K2Cr2O7溶液中存在下列平衡:Cr2O72(橙色) + H2O![]() 2CrO42(黄色) + 2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是( )
2CrO42(黄色) + 2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是( )

A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家开发的一种“磷酸钒锂/石墨离子电池”在4.6V电位区电池总反应为:Li3C6+V2(PO4)3![]() 6C+Li3V2(PO4)3。下列有关说法正确的是
6C+Li3V2(PO4)3。下列有关说法正确的是
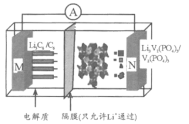
A.该电池比能量高,用Li3V2(PO4)3做负极材料
B.放电时,外电路中通过0.1 mol电子M极质量减少0.7 g
C.充电时,Li+向N极区迁移
D.充电时,N极反应为V2(PO4)3+3Li++3e-=Li3V2(PO4)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com