
【题目】如图,将潮湿的Cl2通过甲装置后再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂不可能是( )

A.饱和食盐水B.浓硫酸C.FeCl2溶液D.NaOH溶液
【答案】A
【解析】
将潮湿的Cl2通过甲装置后再通过放有干燥红色布条的乙装置,红色布条不褪色,说明甲装置装有能够吸收水或者能和氯气发生反应的物质。
A. 饱和食盐水与氯气不反应,同时抑制氯气的溶解,潮湿的氯气通过饱和食盐水后,成分并未改变,干燥红色布条会褪色,与题干要求不符,所以甲装置中所盛试剂不可能是饱和食盐水,故A正确;
B. 将潮湿的氯气通过浓硫酸时,浓硫酸有吸水性,导致氯气中不含水分,再通过放有干燥红色布条的乙装置,红色布条不褪色,符合题干要求,故B错误;
C. FeCl2具有还原性,氯气具有氧化性,氯气与FeCl2溶液反应生成FeCl3,将潮湿的氯气通过NaOH溶液后,再通过放有干燥红色布条的乙装置,红色布条不褪色,符合题干要求,故C错误;
D. 氯气为酸性气体,能和氢氧化钠反应,将潮湿的氯气通过NaOH溶液后,再通过放有干燥红色布条的乙装置,红色布条不褪色,符合题干要求,故D错误;
综上所述,正确答案为A。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】298K时,碳酸、醋酸和亚硫酸的电离平衡常数见下表:
名称 | 碳酸 | 醋酸 | 亚硫酸 |
电离常数(298K) | K1=4.4×10–7 K2=4.7×10–11 | K=1.8×10–5 | K1=1.3×10–2 K2=6.2×10–8 |
(1)298K时,碳酸、醋酸和亚硫酸,从强到弱的顺序_______________________.(用化学式表示)
(2)用离子方程式表示Na2SO3溶液显碱性的原因_______________________。
(3)25℃时,相同浓度的CH3COONa溶液的碱性________Na2CO3溶液的碱性(填“>”“<”或“=”)。
(4)向醋酸溶液中加少量NaOH溶液,醋酸的电离平衡常数________(填“增大”、“减小”、“不变”).
(5)已知常温下:某NaHSO3溶液的pH=5,则该NaHSO3溶液中c(H2SO3) ________ c(SO32-)(填“>”“<”或“=”).
(6)25℃时,PH=4的亚硫酸溶液与PH=10的NaOH溶液等体积混合后,溶液显_________性.
A.酸性 B.碱性 C.中性 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.氢气的燃烧热为 △H =-285.5 kJ·mol-1,则电解水的热化学方程式为2H2O(1)![]() 2H2(g)+O2(g) △H =+285.5 kJ·mol-1
2H2(g)+O2(g) △H =+285.5 kJ·mol-1
B.密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量,则Fe(s)+S(s) ===FeS(s) △H =-95.6 kJ·mol-l
C.500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2 (g)+3H2 (g) ![]() 2NH3 (g)△H =-38.6 kJ·mol-l
2NH3 (g)△H =-38.6 kJ·mol-l
D.相同条件下,在两个相同的恒容密闭容器中,1 mol N2和3 mol H2反应放出的热量与2 mol NH3分解吸收的热量一定一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度和体积下,对反应![]()
![]()
![]() 进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
物质的量 |
|
|
|
|
甲 | amol | amol | 0mol | 0mol |
乙 | 2amol | amol | 0mol | 0mol |
丙 | 0mol | 0mol | amol | amol |
丁 | amol | 0mol | amol | amol |
上述四种情况达到平衡后,![]() 最大的是
最大的是![]()
A.甲B.乙C.丙D.丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁粉与水蒸气反应的装置如图所示,有关该反应的说法正确的是( )
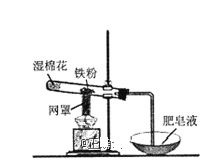
A.该反应属于复分解反应
B.网罩的作用是集中火焰,提高温度
C.湿棉花的作用是给试管降温,防止炸裂
D.铁与水蒸气在高温下的反应产物为Fe2O3和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
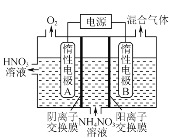
【题目】SO2、NO是大气污染物,NH4NO3、H2SO4等是水体污染物,有效去除这些污染物是一项重要课题。
(1) NO、SO2可以先氧化,后用碱吸收。其氧化过程的反应原理如下:
NO(g)+O3(g)NO2(g)+O2(g);ΔH1=-200.9 kJ·mol-1
SO2(g)+O3(g)SO3(g)+O2(g);ΔH2=-241.6 kJ·mol-1
2SO2(g)+O2(g)2SO3(g);ΔH3=-196.6 kJ·mol-1
则反应2NO2(g)2NO(g)+O2(g)的ΔH= ________kJ·mol-1。
(2) 土壤中的硫循环如图所示,土壤中的黄铁矿(FeS2)在过程Ⅰ中会转化成硫酸亚铁和硫酸,该过程发生的化学方程式为________;某种反硫化细菌在过程Ⅱ中需要有乳酸参与反应消耗硫酸,生成H2S并伴有热量放出,那么乳酸除在反应中作还原剂外,还存在另一作用并解释原因:________。

(3) 电解法除去工业废水中的硝酸铵的装置示意图如图所示,阴极电极反应式为_______。
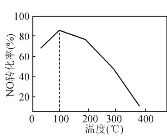
(4) 向恒容密闭容器中充入1 mol NO和2 mol O3,发生如下反应:NO(g)+O3(g)NO2(g)+O2(g);ΔH<0。不同温度下反应相同时间后,体系中NO转化率随温度变化曲线如图。温度低于100 ℃时,NO转化率随温度升高而增大的主要原因是________;当温度高时,O3分解生成活性极高的氧原子,NO转化率随温度升高而降低,可能的原因有:①________,②________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将 0.4 mol A(g)和 0.2 mol B (g)充入 10 L 的恒容密闭容器发生反应:2A(g)+B(g)xC(g)(x是化学计量数),达平衡时测得 C(g) 的浓度为 0.016mol/L,B(g)的物质的量为0.12mol。下列说法中不正确的是
A.x=2
B.达平衡时A的转化率为40%
C.该温度下该反应的化学平衡常数是K=12
D.反应前容器内的压强与平衡后容器内的压强之比为15:13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氨气、空气为主要原料制硝酸。
(1)氨气被氧气催化氧化生成NO的化学方程式是______。
(2)在密闭容器中进行反应![]() 该反应的反应速率
该反应的反应速率![]() 随时间
随时间![]() 变化的关系如图所示,若
变化的关系如图所示,若![]() 、
、![]() 时刻只改变一个条件,下列说法正确的是
时刻只改变一个条件,下列说法正确的是![]() 填选项序号
填选项序号![]() ______。
______。
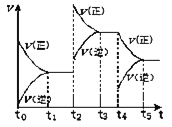
![]() 在
在![]() 时,可依据定容容器内气体的压强保持不变判断反应已达到平衡状态
时,可依据定容容器内气体的压强保持不变判断反应已达到平衡状态
![]() 在
在![]() 时,采取的措施可以是升高温度
时,采取的措施可以是升高温度
![]() 在
在![]() 时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
![]() 在
在![]() 时,容器内
时,容器内![]() 的体积分数是整个过程中的最大值
的体积分数是整个过程中的最大值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列装置分别完成相关实验,能达到实验目的是![]()
A | B | C | D |
制备并收集氨气 | 比较 | 用NaOH溶液滴定锥形瓶中的盐酸溶液 | 制备乙酸乙酯 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com