
【题目】已知:pKa=lgKa,25℃时,H2SeO3 的 pKa1=1.34, pKa2=7.34。用 0.1molL1NaOH 溶 液滴定 20mL0.1molL1H2SeO3 溶液的滴定曲线如图所示(曲线上的数字为 pH)。下列说法不正 确的是

A. a 点所得溶液中:2c(H2SeO3)+c(SeO32)<0.1 molL1
B. b 点所得溶液中:c(H2SeO3)+c(H+)=c(SeO32)+c(OH)
C. c 点所得溶液中:c(Na+)<3c(HSeO3)
D. d 点所得溶液中:c(Na+)>c(SeO3)>c(HSeO3 )
【答案】C
【解析】
A.用0.1molL-1NaOH溶液滴定20mL0.1molL-1H2SeO3溶液,a点溶液中溶质为H2SeO3和NaHSeO3,PH=1.34=Pa1,则c(H2SeO3)=c(HSeO3-)依据物料守恒判断;
B.b点是用0.1molL-1NaOH溶液20ml滴定20mL0.1molL-1H2SeO3溶液,恰好反应生成NaHSeO3,溶液显酸性,依据溶液中电荷守恒和物料守恒计算分析判断;
C.c点PH=7.34=PKa2,依据平衡常数溶液显碱性,溶液中溶质主要为Na2SeO3,SeO32-+H2O?HSeO3-+OH-,Kh=![]() ,c(OH-)=
,c(OH-)=![]() ,c(HSO32-)=c(SO32-),结合溶液中物料守恒分析;
,c(HSO32-)=c(SO32-),结合溶液中物料守恒分析;
D.加入氢氧化钠溶液40ml,NaOH溶液滴定20mL0.1molL-1H2SeO3溶液恰好反应生成Na2SeO3,d点溶液中主要是Na2SeO3和少量NaHSeO3。
A项、用0.1molL-1NaOH溶液滴定20mL0.1molL-1H2SeO3溶液,a点溶液中溶质为H2SeO3和NaHSeO3,PH=1.34=Pa1,电离平衡常数表达式得到则c(H2SeO3)=c(HSeO3-),溶液体积大于20ml,a点所得溶液中:c(H2SeO3)+c(SeO32-)+c(HSeO3-)=2c(H2SeO3)+c(SeO32-)<0.1molL-1,故A正确;
B项、b点是用0.1molL-1NaOH溶液20ml滴定20mL0.1molL-1H2SeO3溶液,恰好反应生成NaHSeO3,溶液显酸性,溶液中电荷守恒c(Na+)+c(H+)=c(HSeO3-)+c(OH-)+2c(SeO32-),物料守恒c(Na+)=c(HSeO3-)+c(SeO32-)+c(H2SeO3),得到:c(H2SeO3)+c(H+)=c(SeO32-)+c(OH-),故B正确;
C项、c点pH=7.19=PKa2,依据平衡常数溶液显碱性,溶液中溶质主要为Na2SeO3,SeO32-+H2OHSeO3-+OH-,Kh=![]() ,c(OH-)=
,c(OH-)=![]() ,带入计算得到:c(HSeO32-)=c(SeO32-),溶液中2n(Na)=3c(Se),2c(Na+)=3[c(SeO32-)+c(H2SeO3)+c(HSeO3-)]=3[c(H2SeO3)+2c(HSeO3-)],故C错误;
,带入计算得到:c(HSeO32-)=c(SeO32-),溶液中2n(Na)=3c(Se),2c(Na+)=3[c(SeO32-)+c(H2SeO3)+c(HSeO3-)]=3[c(H2SeO3)+2c(HSeO3-)],故C错误;
D项、加入氢氧化钠溶液40ml,NaOH溶液滴定20mL0.1molL-1H2SeO3溶液恰好反应生成Na2SeO3,d点溶液中主要是Na2SeO3和少量NaHSeO3,溶液中离子浓度c(Na+)>c(SeO32-)>c(HSeO3-),故D正确。
故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是( )

A. 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
B. 电子从右侧电极经过负载后流向左侧电极
C. 负极发生的电极反应式为N2H4+4OH--4e-===N2+4H2O
D. 该燃料电池持续放电时,OH-从正极向负极迁移,因而离子交换膜需选用阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaTiO3、KH2PO4和NaNO2都属于铁电体,它们具有许多特异的性能如当它受压力而改变形状时产生电流,通电时会改变形状等。
(1)基态Ti原子的价电子排布式为___________,属于___________区元素。
(2)KH2PO4晶体中存在的作用力有___________(选填字母)。
A.离子键 B.共价键 C.氢键
(3)NO2-中N原子的杂化类型为___________,键角(填“>、<或=”)___________120°,其原因是___________。N、O、Na三种元素的第二电离能(I2)由大到小的顺序为___________(用元素符号表示)。
(4)BaTiO3的晶胞如下图所示:

Ti原子的配位数为___________,晶体的密度为ρg/cm3,最近的Ba原子和O原子之间的距离为___________(填计算式)nm。( BaTiO3的摩尔质量为233g/mol,NA为阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今欲用Na2CO3固体配制500mL0.02mol/L的Na2CO3溶液。根据题意填空:
(1)配制该溶液应选用___mL容量瓶。
(2)用托盘天平称取___g固体Na2CO3。
(3)将称好的Na2CO3固体放至500mL的大烧杯中,倒入约200mL蒸馏水,用___搅拌至完全溶解。待冷却至室温后,将烧杯中的溶液用玻璃棒引流转移至容量瓶。
(4)用少量蒸馏水洗涤烧杯___次,并将每次洗涤的溶液都注入容量瓶,轻轻晃动容量瓶,使溶液混和均匀。
(5)向容量瓶中加入蒸馏水,直到液面离刻度线约1-2厘米时,改用____滴加蒸馏水至液面与刻度线相切。盖好瓶塞,摇匀。
(6)配制好的溶液____(填“能”或“不能”)长期存放在容量瓶中。
(7)会使所配制的溶液浓度偏高的是____。
A.在烧杯中溶解溶质,搅拌时不慎溅出少量溶液
B.将烧杯中的溶液注入容量瓶后,未洗涤烧杯
C.加水定容时俯视容量瓶刻度线
D.在转移溶液时,容量瓶中已有少量的蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向某浓度的H2C2O4溶液中逐滴加入已知浓度的NaOH溶液,若pC表示溶液中溶质微粒的物质的量浓度的负对数,则所得溶液中pC(H2C2O4),pC(HC2O4-)、pC(C2O42-)与溶液pH的变化关系如图所示。已知:H2C2O4![]() HC2O4-+H+ Ka1;HC2O4-
HC2O4-+H+ Ka1;HC2O4-![]() C2O42-+H+ Ka2。则下列说法正确的是
C2O42-+H+ Ka2。则下列说法正确的是

A. 当pH=3时,溶液中c(HC2O4-)<c(C2O42-)=c(H2C2O4)
B. pH由3增大到5.3的过程中,水的电离程度逐渐减小
C. 常温下,Ka2=10-5.3
D. 常下随着pH的增大:c2(HC2O4-)/[c(H2C2O4)c(C2O42-)] 的值先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解NaB(OH)4溶液制备H3BO3的原理如下图所示,下列叙述错误的是

A. M室发生的电极反应式:2H2O-4e-=O2↑+4H+
B. a、c为阴离子交换膜,b为阳离子交换膜
C. N室中:a%<b%
D. 理论上每生成1 mol H3BO3,两极室共产生标准状况下16.8 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然水大多含Ca2+、Mg2+、HCO3-等离子,加热会产生水垢,水垢中一定含有CaCO3和Mg(OH)2,可能含有MgCO3。
(1)天然水中的HCO3-来自于空气中的CO2。用相关方程式表示CO2溶于水形成HCO3-的过程。______________________________________________________________
(2)天然水煮沸时,其中微溶的MgCO3转换成难溶的Mg(OH)2,写出发生反应的化学方程式。____________________________________________
为确定某水垢样品的成分,利用CaCO3、MgCO3、Mg(OH)2高温分解的性质,精确称量5.000g水垢样品,用如下图装置进行实验。
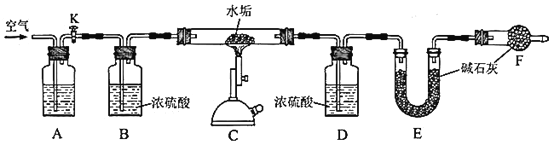
(3)A中盛放的试剂是__________。装置F的作用是_________________________。反应结束后,需要再通入一段时间的空气,目的是_______________________。
(4)利用上述装置测定水垢中Mg(OH)2的含量时,需要测量的数据有__________。
(5)实验测得装置E增重2.200g,请问水垢样品中是否含有MgCO3?判断依据是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是
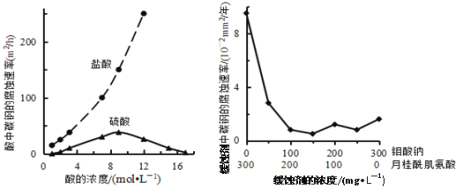
A. 盐酸的浓度越大,腐蚀速率越快
B. 钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
C. 碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
D. 对比盐酸和硫酸两条曲线,可知Cl—也会影响碳素钢的腐蚀速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。已知:
物质 | BaSO4 | BaCO3 | AgI | AgCl | |
溶解度/g(20℃) | 2.4×10-4 | 1.4×10-3 | 3.0×10-7 | 1.5×10-4 |
(1)探究BaCO3和BaSO4之间的转化
实验操作:
试剂A | 试剂B | 试剂C | 加入盐酸后的现象 | |
实验Ⅰ | BaCl2 | Na2CO3 | Na2SO4 | …… |
实验Ⅱ | Na2SO4 | Na2CO3 | 有少量气泡产生,沉淀部分溶解 |
① 实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入盐酸后,______。
② 实验Ⅱ中加入稀盐酸后发生反应的离子方程式是______。
③ 实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因:______。
(2)探究AgCl和AgI之间的转化
实验Ⅲ:
实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
装置 | 步骤 | 电压表读数 | |
| ⅰ.如图连接装置并加入试剂,闭合K | a | |
ⅱ.向B中滴入AgNO3(aq),至沉淀完全 | b | ||
ⅲ.再向B中投入一定量NaCl (s) | c | ||
ⅳ.重复ⅰ,再向B中加入与ⅲ等量NaCl(s) | a |
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
① 实验Ⅲ证明了AgCl转化为AgI,甲溶液可以是______(填序号)。
a. AgNO3溶液 b. NaCl溶液 c. KI溶液
② 实验Ⅳ的步骤ⅰ中,B中石墨上的电极反应式是______。
③ 结合信息,解释实验Ⅳ中b<a的原因:______。
④ 实验Ⅳ的现象能说明AgI转化为AgCl,理由是______。
(3)综合实验Ⅰ~Ⅳ,可得出结论: ______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com