
����Ŀ��A��B��C��D��E����Ԫ��,��֪:
��Aԭ�ӵ������������Ǵ���������������,B����������C�������Ӹ���ԭ�ӵĵ��Ӳ�ṹ��ͬ,Eԭ�ӵ�M���ϵĵ�������K���5��
��������B2������,��������������ܶ���16��
��C�ĵ�����B2��ȼ��,���ɵ���ɫ����F��F��AB2��Ӧ������B2��
��D�ĵ�����B2��ȼ��,��������ɫ����,�����д̼�����ζ������DB2��D��DB2�еĺ���Ϊ50%��������������ش�:
��1��Eλ�ڵ� ���� ��; ]
��2�� C�����ӽṹʾ��ͼ�� ,F�еĻ�ѧ��Ϊ ;
��3�� AB2�ĵ���ʽΪ ; F��AB2��Ӧ�Ļ�ѧ����ʽΪ ;
��4�� C��D��E����Ԫ�ص�ԭ�Ӱ뾶��С�����˳��Ϊ ; ����Ԫ�ط��Żش�
��5��������,E�ĵ�����C������������Ӧˮ�����ˮ��Һ��Ӧ�����ӷ���ʽΪ ��
���𰸡�����16�֣�
��1��3 ��A(2��)
![]() ��2��
��2��![]() (2��)���Ӽ������ۼ�(2��)
(2��)���Ӽ������ۼ�(2��)
��3��:O::C::O: (2��)2Na2O2+2CO2![]() 2Na2CO3+O2(3��)
2Na2CO3+O2(3��)
��4��Na ��S��Cl (2��)
��5��Cl2+2OH-![]() Cl-+ClO-+H2O(3��)
Cl-+ClO-+H2O(3��)
�����������������A��B��C��D��E 5��Ԫ�أ���֪��Aԭ�������������Ǵ�������������������Aԭ��ֻ����2�����Ӳ㣬����������Ϊ4����AΪ̼Ԫ�أ�Eԭ��M���ϵĵ��ӱ�K���5��������M�������Ϊ7����EΪCl��������B2�����壬��������������ܶ���16����B2����Է�������Ϊ32��B������������ԭ�ӵĵ��Ӳ�ṹ��ͬ������BΪOԪ�أ�C�ĵ�����B2��ȼ�գ����ɵ���ɫ����F��F��AB2��Ӧ������B2����FΪNa2O2��CΪNa��DB2��D����������Ϊ50%����D�����ԭ������=32��D�ĵ�����B2��ȼ�գ���������ɫ���棬�����д̼�����ζ������DB2����DΪSԪ�أ���1) ��λ�ڵ���������A�塣![]() ��2�� C�����ӽṹʾ��ͼΪ
��2�� C�����ӽṹʾ��ͼΪ![]() ����Na2O2�еĻ�ѧ��Ϊ���Ӽ������ۼ�����3�� ������̼�ĵ���ʽΪ:O::C::O:��������̼�������Ʒ�Ӧ����̼���ƺ�����������ʽΪ��2Na2O2+2CO2
����Na2O2�еĻ�ѧ��Ϊ���Ӽ������ۼ�����3�� ������̼�ĵ���ʽΪ:O::C::O:��������̼�������Ʒ�Ӧ����̼���ƺ�����������ʽΪ��2Na2O2+2CO2![]() 2Na2CO3+O2����4���ƺ������Ϊͬһ���ڵ�Ԫ�أ������ң��뾶���μ�С���ʴ�Ϊ��Na�� S��Cl����5�� ����������������Һ��Ӧ�����ӷ���ʽΪCl2+2OH-
2Na2CO3+O2����4���ƺ������Ϊͬһ���ڵ�Ԫ�أ������ң��뾶���μ�С���ʴ�Ϊ��Na�� S��Cl����5�� ����������������Һ��Ӧ�����ӷ���ʽΪCl2+2OH-![]() Cl-+ClO-+H2O��
Cl-+ClO-+H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ��ͨ���ⶨ��Ӧ���������ų��������������к��ȡ�����50mL0.5mol/L��������50mL0.55mol/L��NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ����ش��������⣺
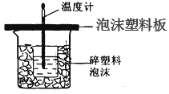
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��__________________����ͼ��֪��װ���в���֮����Ӧ��θ����� ��
��2��ʵ���и���60 mL0.50 mol/L�������50mL 0.55 mol/L��NaOH��Һ���з�Ӧ��������ʵ����ȣ����ų�������________(��������������������)�������к��ȵ���ֵ��______________������������� ���������)��������_____________________________��
��3����ͬѧ��ʵ��ʱ��Щ�������淶����ɲ���к��ȵ���ֵƫ�ͣ�����������ܵ�ԭ����
A������������¶Ⱥ��¶ȼ�û����ˮ��ϴ�ɾ�
B������Ͳ�е�����������Һ����С�ձ�ʱ�����ٻ�
C������ʵ��ĵ������½ϸ�
D������ȡ����ʱ���Ӽ���
E����50mL0.55mol/L����������Һȡ����50mL0.55mol/L�İ�ˮ
��4����V1ml 1.0mol/L HCl��Һ��V2mlδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼�¶ȣ�ʵ��������ͼ��ʾ��ʵ����ʼ�ձ���V1+V2=50mL��
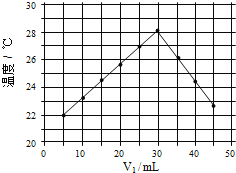
ͨ������ͼ���֪������ʵ��ʱ�����¶� ����������������������������������22������NaOH��Һ��Ũ��ԼΪ mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£����ں��ݵ��ܱ������У��ܱ�ʾ��ӦX (g) + 2Y (g)![]() 2Z (g)һ���ﵽ��ѧƽ��״̬���ǣ�
2Z (g)һ���ﵽ��ѧƽ��״̬���ǣ�
��X��Y��Z�����ʵ���֮��Ϊ1:2:2
�� X��Y��Z��Ũ�Ȳ��ٷ����仯
�� �����е�ѹǿ���ٷ����仯
�� ��λʱ��������n molZ��ͬʱ����2n molY
A. �٢� B. �ڢ� C. �٢� D. �ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ�ֹ�ҵ�Σ���Ȼ��ʳ�κ����ж�������ʳ�á�����Ϊ�������ƵĹ�ҵ�������̣�
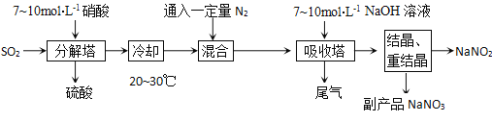
(1)�����ڷ�Ӧ����ͨSO2���������ᣬ���Ʒ�Ӧ���ɵ�NO��NO2���ʵ���֮��ǡ��1:1����ֽ����з�����Ӧ�Ļ�ѧ����ʽΪ�� ���ԴӲ�����ʵĽǶȷ����÷�Ӧ�������Ũ�Ȳ��˹�����С��ԭ���� ��
(2)����������������ѧ��Ӧ����ʽΪ�� ��
(3)Ϊ�ⶨ�������Ƶĺ�������ȡ4.500 g��Ʒ����ˮ���250 mL��Һ��ȡ20.00 mL��Һ����ƿ�У���0.1000 mol��L-1����KMnO4��Һ���еζ���ʵ�������������±���ʾ��

����ƿ�з�����Ӧ�����ӷ���ʽΪ ��
����һ��ʵ�����ݳ����쳣����������쳣��ԭ�������_________(�����)��
A����ʽ�ζ���������ˮϴ�����ñ�Һ��ϴ
B���ζ��յ�ʱ���Ӷ���
C����ƿϴ����δ����
�����ݱ������ݣ��������ù������������Ƶ���������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��K+��Cu2+��Ca2+��Al3+��AlO2-��CO32-��SO42-��Cl-�е�������������ɣ�ȡ��������Һ��������ʵ�飺
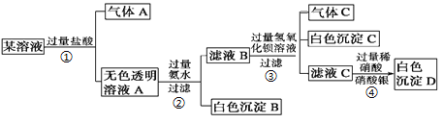
��������ʵ��ش��������⣺
(1)д������A�ĵ���ʽ ������C�Ľṹʽ ��
(2)д���������е����ӷ���ʽ �� ��
(3)��������ʵ�� (������������������)ȷ��ԭ��Һ�д���K+��˵������ ���������е����� (������������������)֤��ԭ��Һ�д���Cl-��˵������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������CO��H2�ڴ����������ºϳɼ״�����Ӧ���£�CO(g)+2H2(g)![]() CH3OH(g)����2L�ܱ������г������ʵ���֮��Ϊ1:2��CO��H2���ڴ��������³�ַ�Ӧ�����ƽ��������CH3OH����������ڲ�ͬѹǿ�����¶ȵı仯��ͼ��ʾ������˵����ȷ����
CH3OH(g)����2L�ܱ������г������ʵ���֮��Ϊ1:2��CO��H2���ڴ��������³�ַ�Ӧ�����ƽ��������CH3OH����������ڲ�ͬѹǿ�����¶ȵı仯��ͼ��ʾ������˵����ȷ����
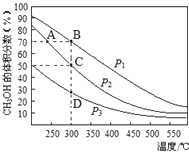
A���÷�Ӧ����H��0����p1��p2��p3
B����C��ʱ��H2ת����Ϊ75%
C����Ӧ���ʣ�����(״̬A)������(״̬B)
D���ں��º�ѹ�����£�����ܱ��������ٳ���1molCH3OH����ƽ��ʱCH3OH�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʵ�Ľ�����ȷ����
A��Al2O3���ͻ��������Ϊ�������۵��
B�����ά���к�ǿ�ĵ���������Ӧ��������ͨ�Ź���
C�������������ں������������Ϊ����������ǿ������������CO2��ˮ
D��FeCl3��Һ������ͭ��ӡˢ��·����������ΪFeCl3����ͭ���ʷ����û���Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(10��)����14.4gCO��CO2�Ļ�����壬�ڱ�״������ռ�����ԼΪ8.96L���ش��������⣺

��1���û�������ƽ��Ħ������__________________________________��
��2�����������̼ԭ�ӵĸ���_____________________________��(��NA��ʾ����٤��������ֵ)
��3���������������ͨ����ͼװ�ã�����ռ�����������
���������ռ����������Ħ������_______________________��
��������������ռ�������������Ϊ__________________________��
���������ռ���������ĵ�������Ϊ__________________________��(��NA��ʾ����٤��������ֵ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������и��黯�����У���ѧ��������ͬ���ǣ� ��
A��HCl��MgCl2 B��H2O��CO2 C��CO2��NaCl D��F2��NaF
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com