
【题目】利用CO和H2在催化剂的作用下合成甲醇,反应如下:CO(g)+2H2(g)![]() CH3OH(g)。在2L密闭容器中充入物质的量之比为1:2的CO和H2,在催化剂作用下充分反应,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g)。在2L密闭容器中充入物质的量之比为1:2的CO和H2,在催化剂作用下充分反应,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
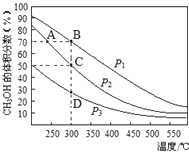
A.该反应的△H<0,且p1<p2<p3
B.在C点时,H2转化率为75%
C.反应速率:ν逆(状态A)>ν逆(状态B)
D.在恒温恒压条件下,向该密闭容器中再充入1molCH3OH,达平衡时CH3OH的体积分数增大
【答案】B
【解析】
试题分析:A.由图可知,升高温度,CH3OH的体积分数减小,平衡逆向移动,则该反应的△H<0,300℃时,增大压强,平衡正向移动,CH3OH的体积分数增大,所以p1>p2>p3,故A错误;B.设向密闭容器充入了1molCO和2molH2,CO的转化率为x,则
CO(g)+2H2(g)═CH3OH(g)
起始 1 2 0
变化 x 2x x
结束 1-x 2-2x x
在C点时,CH3OH的体积分数=![]() =0.5,解得x=0.75,则H2的转化率为75%,故B正确;C.B点对应的温度和压强均大于A点,温度升高、增大压强均使该反应的化学反应速率加快,因此ν逆(状态A)<ν逆(状态B),故C错误;D.由等效平衡可知,在恒温恒压条件下向密闭容器中1mol的CH3OH,达平衡时CH3OH的体积分数相同,故D错误;故选B。
=0.5,解得x=0.75,则H2的转化率为75%,故B正确;C.B点对应的温度和压强均大于A点,温度升高、增大压强均使该反应的化学反应速率加快,因此ν逆(状态A)<ν逆(状态B),故C错误;D.由等效平衡可知,在恒温恒压条件下向密闭容器中1mol的CH3OH,达平衡时CH3OH的体积分数相同,故D错误;故选B。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y 各0.16 mol充入10 L 恒容密闭容器中,发生反应
X(g)+ Y(g)![]() 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列说法正确的是( )
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列说法正确的是( )
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10-5 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠可作为氧气的来源。常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28g,反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)( )
选项 | 二氧化碳 | 碳酸钠 | 转移的电子 |
A | 1mol | 2NA | |
B | 22.4L | 1mol | |
C | 106g | 1mol | |
D | 106g | 2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的沸点由高到低排列的是
①CH3(CH2)2CH3
②CH3(CH2)3CH3
③(CH3)3CH
④(CH3)2CHCH2CH3.
A. ④②①③
B. ②④①③
C. ④①②③
D. ②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素,已知:
①A原子的最外层电子数是次外层电子数的两倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同,E原子的M层上的电子数比K层多5。
②常温下B2是气体,它对氢气的相对密度是16。
③C的单质在B2中燃烧,生成淡黄色固体F。F与AB2反应可生成B2。
④D的单质在B2中燃烧,发出蓝紫色火焰,生成有刺激性气味的气体DB2。D在DB2中的含量为50%。根据以上情况回答:
(1)E位于第 周期 族; ]
(2) C的离子结构示意图是 ,F中的化学键为 ;
(3) AB2的电子式为 ; F和AB2反应的化学方程式为 ;
(4) C、D、E三种元素的原子半径从小到大的顺序为 ; (用元素符号回答)
(5)常温下,E的单质与C的最高价氧化物对应水化物的水溶液反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法不正确的是( )
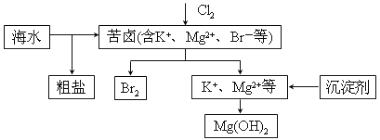
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区分晶体、准晶体和非晶体。
(2) 铁元素位于元素周期表中的第 族,在水溶液中常以Fe2+、Fe3+的形式存在,其中 更稳定。基态Fe原子有________个未成对电子。
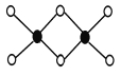
(3)工业上冶炼铝不用氯化铝,因为氯化铝易升华,其双聚物Al2Cl6结构如图所示。1mol该分子中含 个配位键,该分子 (填“是”或“否”)平面型分子。
(4) Fe(CO)5 是一种配位化合物,该物质常温下呈液态,熔点为一20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断:该化合物的晶体中存在的作用力有( )
A.离子键 B.极性键 C.非极性键 D.范德华力 E.氢键 F.配位键
(5)很多金属盐都可以发生焰色反应,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com