
【题目】下列现象或事实的解释正确的是
A.Al2O3作耐火材料是因为氧化铝熔点高
B.光导纤维具有很强的导电能力,应用于制造通信光缆
C.过氧化钠用于呼吸面具中是因为过氧化钠是强氧化剂能氧化CO2和水
D.FeCl3溶液可用于铜质印刷线路板制作是因为FeCl3能与铜单质发生置换反应
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.HF可以用于刻蚀玻璃
B.用小苏打(NaHCO3)发酵面团制作馒头
C.SO2具有漂白性,可用于漂白纸浆,也可以大量用于漂白食品
D.纯碱用于生产普通玻璃,也可用纯碱溶液来除去物品表面的油污
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素,已知:
①A原子的最外层电子数是次外层电子数的两倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同,E原子的M层上的电子数比K层多5。
②常温下B2是气体,它对氢气的相对密度是16。
③C的单质在B2中燃烧,生成淡黄色固体F。F与AB2反应可生成B2。
④D的单质在B2中燃烧,发出蓝紫色火焰,生成有刺激性气味的气体DB2。D在DB2中的含量为50%。根据以上情况回答:
(1)E位于第 周期 族; ]
(2) C的离子结构示意图是 ,F中的化学键为 ;
(3) AB2的电子式为 ; F和AB2反应的化学方程式为 ;
(4) C、D、E三种元素的原子半径从小到大的顺序为 ; (用元素符号回答)
(5)常温下,E的单质与C的最高价氧化物对应水化物的水溶液反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A. 在周期表中,族序数都等于该族元素的最外层电子数
B. 非金属性最强的元素,其最高价氧化物对应水化物的酸性最强
C. 卤素单质随原子序数的增大,其熔沸点逐渐降低
D. 碱金属随原子序数的增大,其熔沸点逐渐降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法不正确的是( )
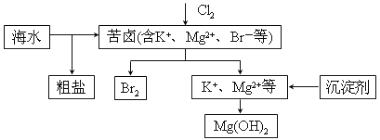
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I(C12H14O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基。I可以用E和H在一定条件下合成:
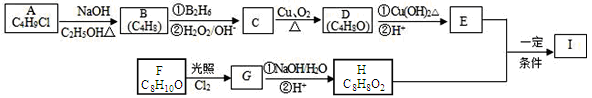
已知以下信息:① A的核磁共振氢谱表明其只有一种化学环境的氢;
②![]()
③化合物F苯环上的一氯代物只有两种且遇Fe3+不变色;
④通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
请回答下列问题:
(1)A的结构简式为 ,B所含官能团的名称是
(2)C的名称为 ,E的分子式为 。
(3)A→B、C→D的反应类型分别为 、 。
(4)写出G→H中反应①的化学方程式 :
(5)I的结构简式为 。
(6)I的同系物J比I的相对分子质量小28,J的同分异构体中能同时满足如下条件:①苯环上只有两个取代基,②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,共有 种(不考虑立体异构)。J的一种同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会密切相关,下列说法正确的是
A.SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等
B.通信光缆的主要成分是晶体Si,太阳能电池的材料主要是SiO2
C.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,都利用了强氧化性
D.氨很容易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如下:
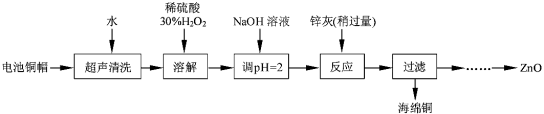
(1)①写出铜帽溶解过程中发生反应的化学方程式 。
②铜帽溶解后需将溶液中过量H2O2除去。除去H2O2的简便方法是 。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点。上述过程中的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 I2+2![]() =2I-+
=2I-+![]()
①滴定选用的指示剂为 ,滴定终点观察到的现象为 。
②若滴定前溶液中H2O2没有除尽,所测得的Cu2+的含量将会 (填“偏高”、“偏低”、“不变”)。
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)
Fe3+ | Fe2+ | Zn2+ | |
开始沉淀的pH | 1.1 | 5.8 | 5.9 |
完全沉淀的pH | 3.2 | 8.8 | 8.9 |
实验中可选用的试剂:30% H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1 NaOH。
由回收铜后的滤液制备ZnO的实验步骤依次为:
① ;
② ;
③ 过滤;
④ ;
⑤ 过滤、洗涤、干燥
⑥ 900℃煅烧。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com