
【题目】短周期常见元素形成的物质A、B、C、D、E、F的转化关系如图1所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同,也可能不同).请回答下列问题: 
(1)若C是一种淡黄色离子化合物,B、E为同种气体,F是一种水溶液显碱性的正盐,写出C与D反应的化学方程式
(2)若A、B反应生成C是人工工业固氮的反应原理,D是双原子分子气态单质,其密度为3.17g/L(标准标况下),F在常温下是一种无色晶体,且受热易分解,写出实验室检验无机盐F中阳离子的方法: .
(3)若C是一种气体,D在常温下是一种无色无味的液体,E为无色气体,F是一种强酸.
①C与D反应的化学方程式 .
②有人认为“浓H2SO4可以干燥气体C”.甲同学为了验证该观点是否正确,用图2装置进行实验.实验过程中,在小铜块和浓硝酸刚开始反应的一段时间内浓H2SO4中未发现有气体逸出,且浓硫酸颜色加深,则你得出的结论是 .
③甲同学设计的实验中,装置Ⅲ的主要作用 .
④甲同学在实验过程中装置Ⅲ内发生一氧化还原反应生成两种钠盐,其中一种是外观与食盐很相似的有毒物质亚硝酸盐,写出该反应的方程式
【答案】
(1)2Na2O2+2CO2=2Na2CO3+O2
(2)取待测样品少许置于试管中,加氢氧化钠溶液,加热,将湿润的红色石蕊试纸置于试管口,若试纸变蓝,则待测样品含铵根离子
(3)3NO2+H2O=2HNO3+NO;NO2能溶于浓H2SO4 , 因而不能用浓H2SO4干燥NO2;吸收尾气(NO2),防止污染空气;2NO2+2NaOH=NaNO2+NaNO3+H2O
【解析】解:(1)若C是一种淡黄色离子化合物判定为Na2O2 , B、E为同种气体为氧气,则A为Na,过氧化钠和D反应得到F是一种水溶液显碱性的正盐,判断F为Na2CO3 , D为CO2 , C与D反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2 ,
所以答案是:2Na2O2+2CO2=2Na2CO3+O2;
(2.)若A、B反应生成C是人工工业固氮的反应原理,判断为是氨气和氢气合成氨的反应,生成化合物C为NH3 , D是双原子分子气态单质,其密度为3.17g/L(标准标况下),则D的摩尔质量=3.17g/L×22.4L/mol=71g/mol,得到D为Cl2 , F在常温下是一种无色晶体,且受热易分解,结合转化关系判断为NH4Cl,实验室检验无机盐F中阳离子是检验铵根离子的存在,设计实验为:取待测样品少许置于试管中,加氢氧化钠溶液,加热,将湿润的红色石蕊试纸置于试管口,若试纸变蓝,则待测样品含铵根离子,
所以答案是:取待测样品少许置于试管中,加氢氧化钠溶液,加热,将湿润的红色石蕊试纸置于试管口,若试纸变蓝,则待测样品含铵根离子;
(3.)若C是一种气体,D在常温下是一种无色无味的液体,E为无色气体,F是一种强酸,推断C为NO2 , D为H2O,F为HNO3 , E为NO,
①C与D反应是二氧化氮和水反应生成硝酸和一氧化氮,反应的化学方程式3NO2+H2O=2HNO3+NO,
所以答案是:3NO2+H2O=2HNO3+NO;
②由现象实验过程中,浓H2SO4中未发现有气体逸出,可以得出NO2能溶于浓硫酸中,
所以答案是:NO2能溶于浓H2SO4 , 因而不能用浓H2SO4干燥NO2;
③甲同学设计的实验中,装置Ⅲ的主要作用是:吸收尾气(NO2),防止污染空气,
所以答案是:吸收尾气(NO2),防止污染空气;
④甲同学在实验过程中装置Ⅲ内发生一氧化还原反应生成两种钠盐,其中一种是外观与食盐很相似的有毒物质亚硝酸盐,是二氧化氮和氢氧化钠溶液反应生成亚硝酸钠、硝酸钠和水,反应的化学方程式为:2NO2+2NaOH=NaNO2+NaNO3+H2O,
所以答案是:2NO2+2NaOH=NaNO2+NaNO3+H2O.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】下列框图所示的转化关系中,甲为生活中常见的金属单质,乙、丙、丁为气体单质,D为家庭中常用物质(部分反应物和生成物及溶剂水已略去).
请回答:
(1)E的化学式为;甲的原子结构示意图为;
(2)反应①的离子方程式为;反应②的化学方程式为;
(3)实验室制取并收集B的操作中,用法收集B,验证B已收集满的方法是(限答一种).
(4)实验室制备丁的方程式为 , 工业上输送丁的管道出现气体泄漏,如何查漏(用方程式表示) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一块表面氧化成氧化钠的金属钠,总质量为5.22 g,投入到94.88 g水(足量)中,待充分反应后收集到氢气0.2 g,求:
(1)其中含氧化钠的质量是多少克?
(2)反应后所得氢氧化钠溶液的质量分数是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室从海藻中提取碘的流程如下:
海藻![]() 海藻灰
海藻灰![]() 海藻灰悬浊液
海藻灰悬浊液![]()

(1)写出提取碘的过程中有关实验操作的名称:①______;③________。
(2)提取碘的过程中可供选择的有机溶剂是( )
A.汽油、酒精 B.四氯化碳、汽油 C.醋酸、酒精
(3)为完成以上①、③两步操作,实验室里有烧杯、玻璃棒、铁架台、烧瓶、导管、酒精灯,尚缺少的玻璃仪器是____________________________________。
(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图所示的实验装置中的错误之处:①______,②________,③________,④________。

(5)为便于控制蒸馏时的温度,操作时使用水浴加热,最后晶体碘在________里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( ) 
A.混合酸中H2SO4浓度为4 molL﹣1
B.200mL混合酸中NO3﹣物质的量为0.2mol
C.AB段的反应为Fe+2Fe3+═3Fe2+ , BC段产生氢气
D.加入铜粉的那份混合酸,反应后剩余0.1mol H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN﹣氧化的反应).
【相关资料】
①氰化物主要是以CN﹣和[Fe(CN)6]3﹣两种形式存在.
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计.
③[Fe(CN)6]3﹣较CN﹣难被双氧水氧化,且pH越大,[Fe(CN)6]3﹣越稳定,越难被氧化.
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)
实验 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
③ | 7 | 60 | 10 |
(2)实验测得含氰废水中的总氰浓度(以CN﹣表示)随时间变化关系如图所示.
实验①中20~60min时间段反应速率:υ(CN﹣)= molL﹣1min﹣1 .
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是 (填一点即可).在偏碱性条件下,含氰废水中的CN﹣最终被双氧水氧化为HCO3﹣ , 同时放出NH3 , 试写出该反应的离子方程式: .
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成下表中内容.(己知:废水中的CN﹣浓度可用离子色谱仪测定)
实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若往20mL 0.01molL﹣l HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
A.HNO2的电离平衡常数:c点>b点
B.b点混合溶液显酸性:c(Na+)>c(NO2﹣)>c(H+)>c(OH﹣)
C.c点混合溶液中:c(OH﹣)>c(HNO2)
D.d点混合溶液中:c(Na+)>c(OH﹣)>c(NO2﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物丙(C13H18O2)是一种香料,其合成路线如图所示。其中甲的相对分子质量通过质谱法测得为88,它的核磁共振氢谱显示只有三组峰;乙与苏合香醇(CHOHCH3)互为同系物。

(1)按照系统命名法,A的名称是________。
(2)C与新制Cu(OH)2悬浊液反应的化学方程式_______________。
(3)丙中含有两个—CH3,在催化剂存在条件下1 mol D与2 mol H2反应可以生成乙,D可以发生银镜反应,则D的结构简式为________。
(4)甲与乙反应的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对比中学常见元素周期表,分析其元素的填充规律,判断下列说法正确的是( ) 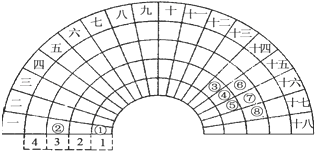
A.③元素形成的单质晶体均属于原子晶体
B.④元素的气态氢化物易液化,是因为其分子间存在氢键
C.②、⑦、⑧对应的简单离子半径依次减小
D.②⑤⑦三种元素形成的盐溶液在25℃时的pH值为7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com