
【题目】下列框图所示的转化关系中,甲为生活中常见的金属单质,乙、丙、丁为气体单质,D为家庭中常用物质(部分反应物和生成物及溶剂水已略去).
请回答:
(1)E的化学式为;甲的原子结构示意图为;
(2)反应①的离子方程式为;反应②的化学方程式为;
(3)实验室制取并收集B的操作中,用法收集B,验证B已收集满的方法是(限答一种).
(4)实验室制备丁的方程式为 , 工业上输送丁的管道出现气体泄漏,如何查漏(用方程式表示) .
【答案】
(1)NH4Cl;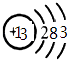
(2)2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;NaOH+NH4Cl ![]() NH3↑+H2O+NaCl
NH3↑+H2O+NaCl
(3)向下排气法;将湿润的红色石蕊试纸放在试管口,变蓝说明NH3满了或者将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生
(4)N2+3H2  2NH3;8NH3+3Cl2=6NH4Cl+N2
2NH3;8NH3+3Cl2=6NH4Cl+N2
【解析】解:甲为生活中常见的金属单质,乙、丙、丁为气体单质,乙、丙在高温高压下催化生成B,可知B为NH3 , 丙、丁点燃生成C,则C为HCl,则丁为Cl2 , 丙为H2 , 乙为N2 , B、C生成E,则E为NH4Cl,D为家庭中常用物质,应为NaCl,说明A应为NaOH,则甲为Al.
(1.)由上分析知E的化学式为NH4Cl,甲为Al,原子结构示意图为 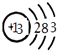 ,所以答案是:NH4Cl;
,所以答案是:NH4Cl; ![]() ;
;
(2.)反应①的离子方程式为2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,反应②的化学方程式为NaOH+NH4Cl ![]() NH3↑+H2O+NaCl,所以答案是:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;NaOH+NH4Cl
NH3↑+H2O+NaCl,所以答案是:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;NaOH+NH4Cl ![]() NH3↑+H2O+NaCl;
NH3↑+H2O+NaCl;
(3.)B为NH3 , 易溶于水,密度比空气的小,用向下排气法收集,将湿润的红色石蕊试纸放在试管口,变蓝说明NH3满了或者将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生说明收集满了,所以答案是:向下排气法;将湿润的红色石蕊试纸放在试管口,变蓝说明NH3满了或者将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生;
(4.)实验室制备Cl2的方程式为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,利用氯气与氨反应生成白烟验证,方程式为8NH3+3Cl2=6NH4Cl+N2 ,
MnCl2+Cl2↑+2H2O,利用氯气与氨反应生成白烟验证,方程式为8NH3+3Cl2=6NH4Cl+N2 ,
所以答案是:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;8NH3+3Cl2=6NH4Cl+N2 .
MnCl2+Cl2↑+2H2O;8NH3+3Cl2=6NH4Cl+N2 .


科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. SO2的摩尔质量为64 g
B. 气体的摩尔体积约为22.4 L·mol-1
C. 0.012kg 12C中所含有的碳原子数即为阿伏加德罗常数
D. 4 g NaOH溶于1 L水所得溶液的物质的量浓度为0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示.将甲醛水溶液与氨水混合蒸发可制得乌洛托品.若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( )
A.1:1
B.2:3
C.3:2
D.2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料、印泥及朱红雕刻漆器等.某温度时,HgS在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( ) 
A.向硫化汞的浊液中加入硫化钠溶液,硫化汞的Ksp减小
B.图中a点对应的是饱和溶液
C.向c点的溶液中加入Hg(NO3)2 , 则c(S2﹣)减小
D.升高温度可以实现c点到b点的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某非金属单质 A 和氧气发生化合反应生成B,B为气体,其体积是反应掉氧气体积的两倍(同温同压)。关于B 分子组成的推测一定正确的是( )
A. 有 2个氧原子 B. 有1个氧原子 C. 有1个A原子 D. 有2个A原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】区别下列有关物质的描述不正确的是( )
A.用氢氧化钠溶液区别乙醇溶液和葡萄糖溶液
B.用碳酸钠溶液区别乙酸和乙酸乙酯
C.用金属钠区别无水乙醇和乙酸乙酯
D.用溴水区别甲烷和乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是几种常见弱酸的电离平衡常数(25 ℃)
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 1.76×10-5 |
H2CO3 | H2CO3 HCO3- | K1=4.4×10-7 K2=4.7×10-11 |
H2S | H2S HS- | K1=1.3×10-7 K2=7.1×10-15 |
H3PO4 | H3PO4 H2PO4- HPO42- | K1=7.1×10-3 K2=6.3×10-8 K3=4.20×10-13 |
回答下列问题:
(1)当温度升高时,K值________(填“增大”“减小”或“不变)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?___________________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是________,最弱的是________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是________,产生此规律的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期常见元素形成的物质A、B、C、D、E、F的转化关系如图1所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同,也可能不同).请回答下列问题: 
(1)若C是一种淡黄色离子化合物,B、E为同种气体,F是一种水溶液显碱性的正盐,写出C与D反应的化学方程式
(2)若A、B反应生成C是人工工业固氮的反应原理,D是双原子分子气态单质,其密度为3.17g/L(标准标况下),F在常温下是一种无色晶体,且受热易分解,写出实验室检验无机盐F中阳离子的方法: .
(3)若C是一种气体,D在常温下是一种无色无味的液体,E为无色气体,F是一种强酸.
①C与D反应的化学方程式 .
②有人认为“浓H2SO4可以干燥气体C”.甲同学为了验证该观点是否正确,用图2装置进行实验.实验过程中,在小铜块和浓硝酸刚开始反应的一段时间内浓H2SO4中未发现有气体逸出,且浓硫酸颜色加深,则你得出的结论是 .
③甲同学设计的实验中,装置Ⅲ的主要作用 .
④甲同学在实验过程中装置Ⅲ内发生一氧化还原反应生成两种钠盐,其中一种是外观与食盐很相似的有毒物质亚硝酸盐,写出该反应的方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com