
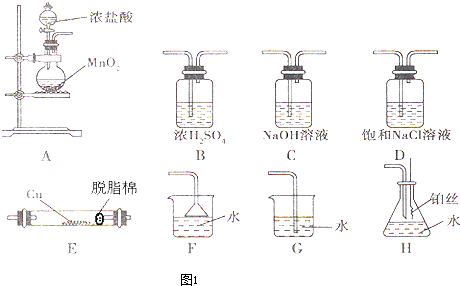
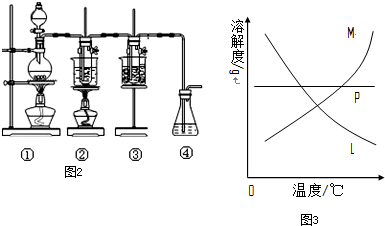
| ||
| ||


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
| 滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 17.10 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| B、用甘氨酸和丙氨酸缩合最多可形成4种二肽 |
| C、分子式为C4H6O2,既能与NaOH溶液反应又能与溴的四氯化碳溶液反应的有机物有4种 |
D、乳酸薄荷醇酯(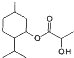 )能发生水解、氧化、消去反应 )能发生水解、氧化、消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
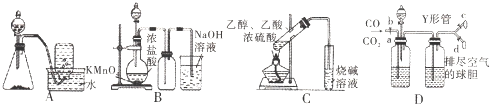
| A、图A装置用Cu和浓硝酸可制取NO |
| B、图B装置可用于实验室制备Cl2 |
| C、图C装置可用于实验室制取乙酸乙酯 |
| D、图D装置可用于实验室分离CO和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c1:c2=1:2 |
| B、平衡时,Y和Z的生成速率之比为2:3 |
| C、X、Y的转化率相等 |
| D、c1的取值范围为0.04 mol/L<c1<0.14 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.16 | B、0.08 |
| C、0.04 | D、0.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Mg2+.、OH-、Cl- |
| B、Cu2+、Ba2+、NO3-、SO42- |
| C、Na+、Mg2+、CO32-、SO42- |
| D、H+、K+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
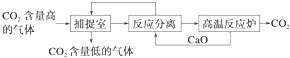
| A、①③ | B、②④ | C、③④ | D、①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com