
【题目】实验室常用氟化钙固体和浓硫酸混合加热制HF:CaF2+H2SO4(浓)![]() CaSO4+2HF↑。下列关于该反应的说法错误的是
CaSO4+2HF↑。下列关于该反应的说法错误的是
A.该反应利用了浓硫酸的酸性和难挥发性
B.CaF2晶体中Ca2+和F-的配位数之比为1:2
C.影响H2SO4和CaSO4熔点的作用力不同
D.HF是极性分子且分子极性强于HC1
科目:高中化学 来源: 题型:
【题目】下列涉及离子方程式书写的评价合理的是( )
选项 | 化学反应及离子方程式 | 评价 |
A | 次氯酸钙溶液中通入足量SO2:Ca2++ClO-+SO2+H2O===CaSO4↓+Cl-+2H+ | 正确 |
B | 实验室用浓盐酸与MnO2反应制Cl2:MnO2+4H++2Cl- | 错误,H+、Cl-的化学计量数应相等 |
C | 硝酸铁溶液中加过量氨水:Fe3++3NH3·H2O===Fe(OH)3(胶体)+3NH4+ | 错误,Fe(OH)3应该是沉淀 |
D | 铝溶于碳酸中:2Al+3H2CO3===2Al3++3H2↑+3CO32- | 正确 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变可使反应速率加快的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变可使反应速率加快的是( )
A. 增加C的量
B. 将容器的体积减小一半
C. 保持体积不变,充入氮气使体系的压强增大
D. 保持压强不变,充入氮气使体系的体积增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸(H3PO4)是一种中强酸,常温下,H3PO4水溶液中含磷微粒的分布分数(平衡时某微粒的浓度占各含磷微粒总浓度的分数)与pH的关系如下图,下列说法正确的是
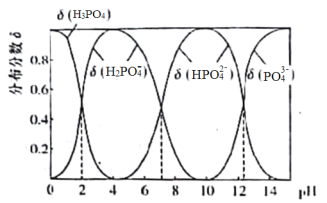

A.滴加NaOH溶液至pH=7,溶液中c(Na+)>c(H2PO4-)+c(HPO42—)+c(PO43—)
B.该温度下,H3PO4的三级电离常数Ka3>10-12
C.H3PO4的电离方程式为:H3PO4 3H+ + PO43—
D.滴加少量Na2CO3溶液,化学反应方程式为3 Na2CO3 + 2H3PO4=2Na2PO4+3H2O+3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积可变的密闭容器中,加入一定量的X、Y,发生反应:mX(g)![]() nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
1L | 2L | 4L | |
100℃ | 1.00mol/L | 0.75mol/L | 0.53mol/L |
200℃ | 1.20mol/L | 0.90mol/L | 0.63mol/L |
300℃ | 1.30mol/L | 1.00mol/L | 0.70mol/L |
下列说法正确的是( )
A.温度不变,压强增大,Y的质量分数减少
B.体积不变,温度升高,平衡向逆反应方向移动
C.m>n
D.Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 向NaHS溶液中加入盐酸产生大量气泡 | 氯的非金属性强于硫 |
B | 向溶液中加盐酸酸化的氯化钡溶液产生白色沉淀 | 原溶液中一定含 |
C | 将铁片和铜片用导线连接后插入浓硝酸,铁片表面产生气泡 | 铜的活泼性强于铁 |
D | 常温下测得CH3COONH4溶液pH=7 | 相同温度下CH3COOH和NH3·H2O电离常数相同 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物分子结构式如下图,下列说法正确的是( )

A. 取少量该有机物,滴加酸性高锰酸钾溶液,微热,有气体产生
B. 所有的碳原子不可能处在同一个平面上
C. 所有的氧原子不可能同时处在苯环平面上
D. 所有的氢原子有可能同时处在苯环平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题
I.下列几种微粒或物质
①14C ②16O ③14N ④18O ⑤O2 ⑥O3
⑦CH3-CH3 ⑧C2H6 ⑨CH3- CH2-OH ⑩ CH3-O-CH3
(1)互为同位素的是______,(填序号,下同)质子数不同中子数相同的是______________
(2)互为同素异形体的是_________, 互为同分异构体的是_____________________
II.在25 C、101 kPa的条件下,

对于反应H2(g)+Cl2(g)= 2HCl(g), 测得生成2 mol HCI(g)时,反应过程中放出183 kJ的热量,则断开1 mol H- Cl键所需的能量是____ kJ.

III.如图所示的原电池装置中,正极的电极反应方程式是________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Br+H2![]() HBr+H的能量变化如图所示,根据图像判断下列说法正确的是( )
HBr+H的能量变化如图所示,根据图像判断下列说法正确的是( )
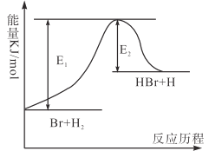
A.HBr的能量比H2的能量高
B.反应2C+O2=2CO的能量变化过程,与该图的变化过程相似
C.若该反应开始时加入催化剂,则反应达到平衡时吸收的能量增多
D.该反应中,H-H键断裂吸收的总能量大于H-Br键形成释放的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com