
【题目】下列是某同学对相应反应的离子方程式所作的评价,其中对应的评价合理的是( )
编号 | 化学反应 | 离子方程式 | 评价 |
A | 把MgSO4溶液滴入Ba(OH)2溶液 | Mg2++2OH-=Mg(OH)2↓ | 正确 |
B | 氧化铜与稀盐酸反应 | CuO+2H+=Cu2++H2O | 错误,不反应 |
C | 向FeCl2溶液中通入氯气 | Fe2++Cl2=Fe3++2Cl- | 错误,电荷不守恒 |
D | 向沸水滴入饱和氯化 铁溶液 | Fe3++3H2O | 正确 |
A.AB.BC.CD.D
【答案】C
【解析】
A项、硫酸镁和氢氧化钡反应MgSO4+Ba(OH)2═BaSO4↓+Mg(OH)2↓,氢氧化钡为易溶于水的强碱、硫酸镁为易溶于水的盐,两者都拆成离子,氢氧化镁沉淀和硫酸钡沉淀应写化学式,离子反应方程式为:Ba2++2OH-+Mg2++SO42-=BaSO4↓+Mg(OH)2↓,离子反应方程式、评价都错误,故A错误;
B项、氧化铜与稀盐酸反应在常温下即可进行,CuO+2H+═Cu2++H2O,离子反应方程式、评价都错误,故B错误;
C项、向氯化亚铁溶液中通入氯气发生反应2FeCl2+Cl2=2FeCl3,离子反应为2Fe2++Cl2=2Fe3++2Cl-,离子反应方程式错误,评价正确,故C正确;
D项、向沸水中滴加饱和氯化铁溶液制备Fe(OH)3胶体的离子反应为Fe3++3H2O![]() Fe(OH)3+3H+,离子反应方程式错误,故D错误;
Fe(OH)3+3H+,离子反应方程式错误,故D错误;
故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:①H2(g)+ ![]() O2(g)=H2O(g);ΔH1= akJ·mol-1
O2(g)=H2O(g);ΔH1= akJ·mol-1
②2H2(g)+O2(g) = 2H2O(g);ΔH2= b kJ·mol-1 ③ H2(g)+ ![]() O2(g)=H2O(l);ΔH3= c kJ·mol-1
O2(g)=H2O(l);ΔH3= c kJ·mol-1
④2H2(g)+O2(g) = 2H2O(l);ΔH4= d kJ·mol-1,下列关系式中正确的是( )
A.2a=b<0B.b>d>0C.a<c<0D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、G为中学化学中常见的物质,其中A为单质,B、C、D、G均为化合物。它们之间存在以下的相互转化关系:
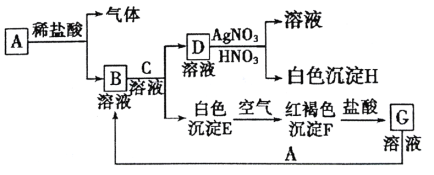
试回答:
(1)写出A的化学式___。
(2)如何用实验证明B溶液中是否含有G?(请写出实验的步骤、现象和结论)___。
(3)写出由E转变成F的化学方程式___。
(4)向G溶液中加入A的有关离子反应方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
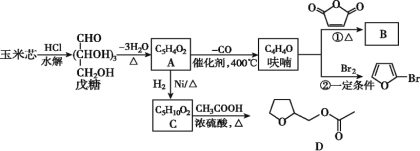
【题目】呋喃(C4H4O)是生产抗流感药物磷酸奥司他韦(又名达菲)的原料之一,以玉米芯为原料制备呋喃及相关衍生物的一种工艺流程如下:
已知:①A可以发生银镜反应;②![]() +‖
+‖![]()
![]() 。
。
试回答下列问题:
(1)D的分子式为____。
(2)呋喃的结构简式为____;②的反应类型为______。
(3)A发生银镜反应的化学方程式为_____________。
(4)反应①在有机合成中具有重要意义,则B的结构简式为________。
(5)C的同分异构体中,含有“![]() ”结构的共有____种(不含立体异构),其中能发生银镜反应,且核磁共振氢谱中有2组吸收峰的有机物的结构简式为______。
”结构的共有____种(不含立体异构),其中能发生银镜反应,且核磁共振氢谱中有2组吸收峰的有机物的结构简式为______。
(6)参照上述合成路线,设计以环己烯和丙烯为原料制备![]() 的合成路线(无机试剂任选)。_____________________________________________________________
的合成路线(无机试剂任选)。_____________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】GaN凭借其出色的功率性能、频率性能以及散热性能,在光电领域和高频微波器件应用等方面有广阔的前景。
(1) Johnson等人首次在1100℃下用镓与氨气制得氮化镓,该可逆反应每生成1 mol H2放出10.3 kJ热量。该反应的热化学方程式是_____。(己知金属镓的熔点是29.8℃,沸点是2403℃;氮化镓的熔点为1700℃)
(2)在恒容密闭容器中,加入一定量的液态镓与氨气发生上述反应,测得反应平衡体系中NH3的体积分数与压强(p)、温度(T)的关系如图所示(已知图中T1和T2的温度均小于1700℃)。
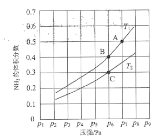
①下列说法正确的是________(填标号)。
a.相同条件下,Ga(OH)3 的碱性比Al(OH)3强
b.当c(NH3)=c(H2)时,一定达到了化学平衡状态
c. A点和C点化学平衡常数的关系是:KA< KC
d.温度一定时,达平衡后再充入氦气(氦气不参与反应),NH3的转化率增大.
②气相平衡中用组分的平衡分压代替物质的量浓度也可以表示平衡常数(记作Kp),已知在T1℃时体系的压强初始压强为a Pa,则B点的Kp=____(用含a表示且保留2位有效数字)。
(3)电解精炼法提纯镓是工业上常用的方法。具体原理如图所示:
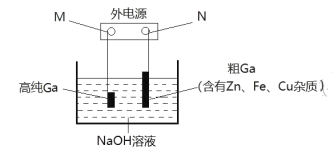
已知:金属的活动性Zn>Ga>Fe>Cu;镓化学性质与铝相似。
①M为电源的_______极,电解精炼镓时产生阳极泥的主要成分是________。
②电解过程中阳极产生的离子迁移到达阴极并在阴极析出高纯镓。请写出电解过程的阴极的电极反应__________。
③电解过程中需控制合适的电压,若电压太高时阴极会产生H2导致电解效率下降。若外电路通过0.2mole时,阴极得到3.5g的镓。则该电解装置的电解效率η=_________(η=生成目标产物消耗的电子数+转移的电子总数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10L密闭容器中加入5.0molSO2、4.5molO2,经10min后反应达到平衡,此时容器中气体的平均分子量为58。请计算(写出计算过程):
(1)10min内SO2的转化率;
(2)容器内反应前与平衡时的压强之比(最简整数比) ;
(3)该温度下的平衡常数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH、FeCl3、AlCl3三种固体组成的混合物溶于足量水后,产生1.07g沉淀,再向所得悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.

试回答:
(1)A点沉淀为______,(填化学式)B点沉淀为________.(填化学式)
(2)原固体混合物中各物质的物质的量分别是多少?___________
(3)C点处的盐酸的体积是多少毫升? ____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z和W在周期表中的位置如图所示,其中X、Y、Z均为短周期元素,且X、Y、W原子的最外层电子数之和为13。下列说法不正确的是( )
X | Y | ||
Z | |||
W |
A. 原子半径:![]()
B. W的最高价氧化物对应的水化物可能为强碱
C. 上述四种元素可形成化合物![]()
D. 一定条件下,Z单质与X的氢化物及Y的氢化物均能反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com