
【题目】Ⅰ、一定温度下,在容积为V L的密闭容器中进行反应:aN(g)![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:

(1)此反应化学方程式中![]() =______。
=______。
(2)t1到t2时刻,以N的浓度变化表示的平均反应速率为:______。
(3)下列叙述中能说明上述反应达到平衡状态的是______。
A.反应中M与N的物质的量之比为1︰1
B.N的质量分数在混合气体中保持不变
C.单位时间内每消耗a mol N,同时生成b mol M
D.混合气体的总物质的量不随时间的变化而变化
E.混合气体的压强不随时间的变化而变化
F.混合气体的总质量不随时间的变化而变化
II、某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:

实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是____,t2~t3速率变化的主要原因是___。
(2)实验②放出氢气的量减少的原因是______。
【答案】 2 ![]() mol·L-1·min-1 BDE 反应放热,溶液温度升高,反应速率加快; 随反应进行,盐酸的浓度减小较大,反应速度减慢。 Fe3+氧化性大于H+,所以锌先与Fe3+反应,故氢气量减少
mol·L-1·min-1 BDE 反应放热,溶液温度升高,反应速率加快; 随反应进行,盐酸的浓度减小较大,反应速度减慢。 Fe3+氧化性大于H+,所以锌先与Fe3+反应,故氢气量减少
【解析】Ⅰ、(1)平衡时消耗N是8mol-2mol=6mol,生成M是5mol-2mol=3mol,因此此反应化学方程式中![]() =6/3=2。(2)t1到t2时刻,消耗N是6mol-4mol=2mol,所以以N的浓度变化表示的平均反应速率为
=6/3=2。(2)t1到t2时刻,消耗N是6mol-4mol=2mol,所以以N的浓度变化表示的平均反应速率为![]() mol·L-1·min-1。(3)A.反应中M与N的物质的量之比为1︰1不能说明正逆反应速率相等,没有达到平衡状态,A错误;B.N的质量分数在混合气体中保持不变说明正逆反应速率相等,达到平衡状态,B正确;C.单位时间内每消耗a mol N,同时生成b mol M均表示正反应速率,不一定处于平衡状态,C错误;D.正反应体积减小,则混合气体的总物质的量不随时间的变化而变化说明反应达到平衡状态,D正确;E.正反应体积减小,则混合气体的压强不随时间的变化而变化说明反应达到平衡状态,E正确;F.根据质量守恒定律可知混合气体的总质量是定值,不能据此判断,F错误,答案选BDE。II、(1)实验①中t1~t2速率逐渐增大,说明反应放热,溶液温度升高,反应速率加快;t2~t3速率逐渐减小,说明随反应进行,盐酸的浓度减小较大,反应速度减慢。(2)由于Fe3+氧化性大于H+,所以锌先与Fe3+反应,故氢气量减少。
mol·L-1·min-1。(3)A.反应中M与N的物质的量之比为1︰1不能说明正逆反应速率相等,没有达到平衡状态,A错误;B.N的质量分数在混合气体中保持不变说明正逆反应速率相等,达到平衡状态,B正确;C.单位时间内每消耗a mol N,同时生成b mol M均表示正反应速率,不一定处于平衡状态,C错误;D.正反应体积减小,则混合气体的总物质的量不随时间的变化而变化说明反应达到平衡状态,D正确;E.正反应体积减小,则混合气体的压强不随时间的变化而变化说明反应达到平衡状态,E正确;F.根据质量守恒定律可知混合气体的总质量是定值,不能据此判断,F错误,答案选BDE。II、(1)实验①中t1~t2速率逐渐增大,说明反应放热,溶液温度升高,反应速率加快;t2~t3速率逐渐减小,说明随反应进行,盐酸的浓度减小较大,反应速度减慢。(2)由于Fe3+氧化性大于H+,所以锌先与Fe3+反应,故氢气量减少。


科目:高中化学 来源: 题型:
【题目】海水中含有80多种元素,是重要的物质资源宝库,同时海水具有强大的自然调节能力,为解决环境污染问题提供了广阔的空间。
(1)①已知不同pH条件下,水溶液中碳元素的存在形态如下图所示。下列说法不正确的是______________(填字母序号)。

a.pH=8时,溶液中含碳元素的微粒主要是HCO3-
b.A点,溶液中H2CO3和HCO3-浓度相同
c.当c(HCO3-)=c(CO32-)时,c(H+)>c(OH -)
②向上述pH=8.4的水溶液中加入NaOH溶液时发生反应的离子方程式是______________。
(2)海水pH稳定在7.9—8.4之间,可用于烟道气中CO2和SO2的吸收剂。
①海水中含有的OH -可以吸收烟道气中的CO2同时为海水脱钙,生产CaCO3。写出此反应的离子方程式:__________。
②已知:25℃时,H2CO3电离平衡常数K1=4.3×10-7 K2=5.6×10 -11
H2SO3电离平衡常数K1=1.5×10-2 K2 =6.0×10-8
海水中含有的HCO3-可用于吸收SO2,该过程的离子方程式是_______________。
(3)洗涤烟气后的海水呈酸性,需处理后再行排放。与新鲜海水混合同时鼓入大量空气排出部分CO2,是一种处理的有效方式。
①通入O2可将酸性海水中的硫(IV)氧化,该反应的离子方程式是_______________。
②上述方式使处理后海水pH升高的原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 风化、液化、氧化、酸化都是化学反应
B. 碱性氧化物一定是金属氧化物
C. NH4Cl、HCl中均含共价键,二者均为共价化合物
D. 需要加热才能发生的反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关电解质溶液说法正确的是( )
A. 1.0mol/L NH4HCO3溶液pH=8.0。由此可知Ka1(H2CO3)>Kb(NH3·H2O)>Ka2(H2CO3)
B. 向氨水中加入NH4C1固体,溶液中![]() 增大
增大
C. 向CH3COONa溶液中滴加硫酸至中性时,c(SO42ˉ)<c(CH3COOH)
D. 下图中曲线可以表示向100mL 0.01 mol/LCH3COOH溶液中逐滴加入0.02mol/L NaOH溶液的pH变化情况(溶液体积变化忽略不计)。
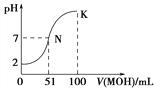
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将 2 mol SO2 和 1 mol O2 充入一定容密闭容器中,在催化剂存在下进行下列反应: 2SO2(g)+ O2(g) ![]() 2SO3(g);当达到平衡状态时,下列说法中正确的是
2SO3(g);当达到平衡状态时,下列说法中正确的是
A. 生成 SO3 为2 mol
B. 反应完全停止
C. SO2 和 SO3 物质的量之和为 2mol
D. SO2 的物质的量和SO3 物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)( )
选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
A | NaCl(泥沙) | 水 | 过滤、结晶 |
B | CO2( CO ) | O2 | 点燃 |
C | Fe(Zn ) | 稀硫酸 | 结晶 |
D | CO2(HCl ) | NaOH溶液 | 萃取 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成化合物D。
(1)易与C发生化学反应的酸是________,写出反应的化学方程式:_________________。
(2)C与纯碱混合高温熔融时生成D和气体E;将生成的全部气体E通入全部D溶于足量的水得到的溶液中,又发生化学反应生成化合物F。
①分别写出上述过程中,生成D和生成F的化学反应方程式:_____________、___________。
②要将纯碱高温熔化,下列坩埚中可选用的是______(填序号)。
a.普通玻璃坩埚 b.石英玻璃坩埚 c.氧化铝坩埚 d.铁坩埚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,已知Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=7.8×10-13。现向等浓度NaCl和NaBr的混合溶液中逐滴加入稀AgNO3溶液,先沉淀的是
A. AgCl B. AgBr C. 同时沉淀 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的恒容密闭容器中,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
A. 速率之比ν(A2) :ν(B2) :ν(AB)=1:1:2
B. 浓度之比c(A2): c(B2): c(AB)=1:1:2
C. 单位时间内生成2n mol AB,同时消耗n mol A2
D. 各物质的浓度不再改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com