
【题目】25℃时,已知Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=7.8×10-13。现向等浓度NaCl和NaBr的混合溶液中逐滴加入稀AgNO3溶液,先沉淀的是
A. AgCl B. AgBr C. 同时沉淀 D. 无法判断
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为六种常见的短周期主族元素,原子序数依次增大。A、B能写出两种常温下均呈液态的化合物,D原子核外的M层上有3个电子,A、C同主族,B、E同主族。根据信息回答下列问题:
(1)D在元素周期表中的位置为_______。
(2)六种元素中,原子半径最大的是__________(填元素符号)。
(3)B对应的氢化物的沸点高于E对应的氢化物,主要原因是__________。
(4)由A分别和B、E、F所形成的三种化合物中,热稳定性最差的是__________(填化学式)。
(5)由A、B形成的两种化合物中,一种物质可以转化为另外一种物质,反应的化学方程式为____________________ 。
(6)F对应的单质常用于自来水消毒,该单质与水反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、一定温度下,在容积为V L的密闭容器中进行反应:aN(g)![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:

(1)此反应化学方程式中![]() =______。
=______。
(2)t1到t2时刻,以N的浓度变化表示的平均反应速率为:______。
(3)下列叙述中能说明上述反应达到平衡状态的是______。
A.反应中M与N的物质的量之比为1︰1
B.N的质量分数在混合气体中保持不变
C.单位时间内每消耗a mol N,同时生成b mol M
D.混合气体的总物质的量不随时间的变化而变化
E.混合气体的压强不随时间的变化而变化
F.混合气体的总质量不随时间的变化而变化
II、某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:

实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是____,t2~t3速率变化的主要原因是___。
(2)实验②放出氢气的量减少的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3 H20![]() NH4 +0H ,若要使平衡向逆反应方向移动,同时使 c(OH-)增大,应加入适量的物质是(忽略溶解热)( )
NH4 +0H ,若要使平衡向逆反应方向移动,同时使 c(OH-)增大,应加入适量的物质是(忽略溶解热)( )
①NH4C1 固体 ②硫酸 ③NaOH 固体 ④水 ⑤加热 ⑥加入少量 MgS04 固体
A.仅①②③⑤ B. 仅③⑥ C. 仅③ D. 仅③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 符合同一通式的两种有机物一定互为同分异构体
B. 苯乙烯分子中的所有碳原子可能在同一平面上
C. 同分异构现象的存在是有机物种类繁多的原因之一
D. 乙醇和乙酸生成酯和酯的水解反应都属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PTT是近几年来迅速发展起来的新型热塑性聚酯材料,具有优异性能,能作为工程塑料、纺织纤维和地毯等材料而得到广泛应用.其合成路线可设计为:
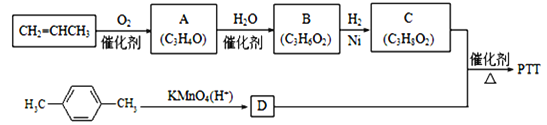
其中A、B、C均为链状化合物,A能发生银镜反应,C中不含甲基,1molC可与足量钠反应生成22.4LH2(标准状况)。请回答下列问题:
(1)A中所含官能团的名称为______,B的结构简式为______.
(2)由物质C与D反应生成PTT的化学方程式为______,该反应类型为______。
(3)D有多种同分异构体,符合下列条件的同分异构体中,写出任意两种的结构简式:______,_________。
①能发生银镜反应,但不能发生水解反应
②能与FeCl3溶液反应显紫色,但不能与NaHCO3溶液反应
③核磁共振氢谱只有3组峰
(4)请写出以CH2=CHCH3为主要原料(无机试剂任用)制备CH3CH(OH)COOH的合成路线流程图(须注明反应条件)。(合成路线常用的表示方法为:![]() )
)
![]() _________________________________
_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料科学发展日新月异。
(1)某太阳能吸热涂层以镍或镍合金空心球为吸收剂,基态镍原子的价层电子排布式是____________。某镍配合物结构如图5所示,分子内含有的作用力有_______________(填序号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(2)某金属M与C60可制备一种超导材料,晶胞如图1所示,M原子位于晶胞的棱上与内部。该材料的化学式为__________________。
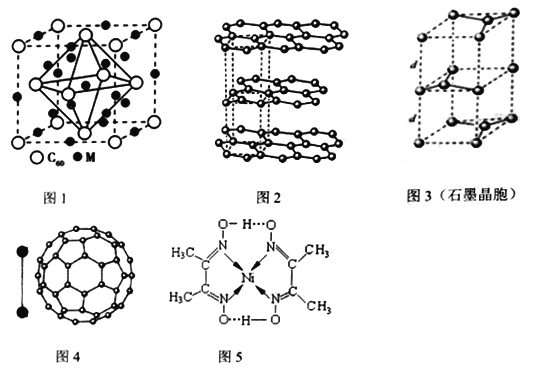
(3)碳的一种同素异形体——石墨,其晶体结构如图2所示,碳原子的杂化方式_____________,图3虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为________________个。
(4)有机太阳能固体电池材料含有高纯度C60,其结构如图4,1molC60分子中π键的数目为_______,C60的晶胞结构如图4,则一个C60分子周围有_________个紧邻C60分子,其固体属于___________晶体。C60能在溶剂二硫化碳中溶解而不溶于水的原因是_________________。已知该晶胞的密度为ρ g·cm-3则两个最近C60间的距离为_________________nm(列出计算式,已知阿伏伽德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,A是淡黄色固体,B的焰色反应为黄色,C是目前使用最多的半导体,
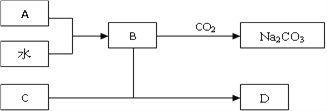
(1)A的化学式为______,为何盛装B溶液的试剂瓶不能用磨口玻璃塞,请用化学方程式解释____________________________。

(2)D的水溶液呈___性,将过量CO2通入D溶液中,现象为__________。
(3)为证明酸性:碳酸 > 硅酸,有同学设计如右实验装置:
请指出该装置中不合理之处____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com