
【题目】如图,A是淡黄色固体,B的焰色反应为黄色,C是目前使用最多的半导体,
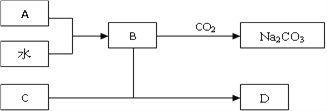
(1)A的化学式为______,为何盛装B溶液的试剂瓶不能用磨口玻璃塞,请用化学方程式解释____________________________。

(2)D的水溶液呈___性,将过量CO2通入D溶液中,现象为__________。
(3)为证明酸性:碳酸 > 硅酸,有同学设计如右实验装置:
请指出该装置中不合理之处____________
【答案】 Na2O2 SiO2+2NaOH=Na2SiO3+H2O 碱 有白色沉淀生成。 盐酸有挥发性,通入Ns2SiO3溶液中的既有CO2也有HCl气体,不能说明碳酸的酸性强于硅酸(答案合理即可给分)
【解析】试题分析:A是淡黄色固体,B的焰色反应为黄色,所以A是过氧化钠,B是氢氧化钠;C是目前使用最多的半导体,C为硅。硅与氢氧化钠反应生成硅酸钠和氢气。
解析:根据以上分析,(1)过氧化钠的化学式为Na2O2,二氧化硅与氢氧化钠反应生成硅酸钠,所以盛装氢氧化钠溶液的试剂瓶不能用磨口玻璃塞,化学方程式为SiO2+2NaOH=Na2SiO3+H2O。
(2)硅酸钠是强碱弱酸盐,水溶液呈碱性,将过量CO2通入硅酸钠溶液中生成白色硅酸沉淀。
(3)盐酸具有挥发性,盐酸、二氧化碳都能使硅酸钠溶液生成硅酸沉淀,通入Ns2SiO3溶液中的既有CO2也有HCl气体,不能说明碳酸的酸性强于硅酸。


科目:高中化学 来源: 题型:
【题目】25℃时,下列有关电解质溶液说法正确的是( )
A. 1.0mol/L NH4HCO3溶液pH=8.0。由此可知Ka1(H2CO3)>Kb(NH3·H2O)>Ka2(H2CO3)
B. 向氨水中加入NH4C1固体,溶液中![]() 增大
增大
C. 向CH3COONa溶液中滴加硫酸至中性时,c(SO42ˉ)<c(CH3COOH)
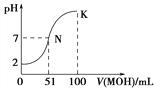
D. 下图中曲线可以表示向100mL 0.01 mol/LCH3COOH溶液中逐滴加入0.02mol/L NaOH溶液的pH变化情况(溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,已知Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=7.8×10-13。现向等浓度NaCl和NaBr的混合溶液中逐滴加入稀AgNO3溶液,先沉淀的是
A. AgCl B. AgBr C. 同时沉淀 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的下列溶液:①NH4Cl ②(NH4)2Fe(SO4)2 ③(NH4)2SO4 ④CH3COONH4⑤NH4HSO4中,c(NH4+)由大到小的顺序为
A. ②③①⑤④ B. ②③⑤①④ C. ⑤④①③② D. ②③①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是
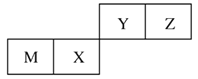
A. 原子半径Z<M
B. Y的最高价氧化物对应水化物的酸性比X的弱
C. X的最简单气态氢化物的热稳定性比Z的小
D. Z位于元素周期表中第2周期、第ⅥA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的恒容密闭容器中,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
A. 速率之比ν(A2) :ν(B2) :ν(AB)=1:1:2
B. 浓度之比c(A2): c(B2): c(AB)=1:1:2
C. 单位时间内生成2n mol AB,同时消耗n mol A2
D. 各物质的浓度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取体积相同的KI、Na2SO3、FeBr2溶液,分别通入足量氯气,当恰好完全反应时,三种溶液消耗氯气的物质的量相同,则KI、Na2SO3、FeBr2溶液的物质的量浓度之比为( )
A. 2:1:2 B. 2:1:3
C. 6:3:2 D. 3:7:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com